

14/08/2024
Tóm tắt:
Do có diện tích bề mặt lớn, cấu trúc xốp, kích thước hạt nhỏ và thành phần hóa học đa dạng, tro bay ngày càng được các nhà khoa học quan tâm nghiên cứu với vai trò là vật liệu hấp phụ (VLHP) tiềm năng, có khả năng hấp phụ tốt các chất ô nhiễm từ môi trường và hiệu quả trong xử lý nước thải. Tuy nhiên, nghiên cứu sử dụng tro bay để xử lý xanh methylen (MB) trong nước thải còn rất hạn chế. Vì vậy nghiên cứu được thực hiện nhằm đánh giá khả năng hấp phụ MB của tro bay biến tính (TBBT) bằng NaOH rắn 96% ở 600oC trong 1 giờ. Phương pháp hấp phụ tĩnh được sử dụng để đánh giá khả năng hấp phụ MB trong môi trường nước của TBBT với các yếu tố ảnh hưởng như thời gian hấp phụ, giá trị pH của dung dịch và nồng độ MB ban đầu. Kết quả nghiên cứu cho thấy, khả năng hấp phụ của TBBT hơn nhiều so với mẫu tro bay thô ban đầu (TB); thời gian đạt cân bằng hấp phụ khoảng 90 phút; giá trị pH tối ưu là 7 với hiệu suất hấp phụ đạt 98,53%; nồng độ MB là 100mg/l thì dung lượng hấp phụ đạt cao nhất là 16.87 mg/g. Vì vậy, sử dụng tro bay biến tính để hấp phụ MB không chỉ giúp giải quyết các vấn đề môi trường, tận dụng nguồn chất thải mà còn mang lại lợi ích về kỹ thuật và kinh tế, góp phần vào sự phát triển bền vững của các ngành công nghiệp liên quan.
Từ khóa: Hấp phụ, tro bay biến tính, xanh methylen.
Ngày nhận bài: 10/6/2024; Ngày sửa chữa: 5/7/2024; Ngày duyệt đăng: 24/7/2024.
Research on the adsorption of methylene blue by modified fly ash using calcination-hydrothermal method with solid NaOH
Abstract:
Due to high surface area, porous structure, small particle size and rich mineral composition, fly ash has been widely studied as a potential adsorbent material (VLHP), which exhibits a significant capacity to adsorb pollutants from the environment and can be effectively use in wastewater treatment. However, current research on using fly ash for methylene blue (MB) removal from wastewater is limited. Therefore, this study aimed to evaluate the MB adsorption capacity of modified fly ash (TBBT) with 96% solid NaOH at 600oC for 1 hour. The static adsorption study has been conducted on the adsorption of MB solution of different concentrations on TBBT at varying pH, contact time and initial concentration of dye solution. Research results show that the adsorption capacity of TBBT is much greater than the original raw fly ash sample (TB); the equilibrium time of TBBT is about 90 minutes; the optimal pH value is 7 with adsorption efficiency of 98.53% and MB concentration is 100 mg/l. The highest adsorption capacity is 16.87 mg/g. Therefore, using TBBT for MB adsorption can not only solve environmental problems, utilizing waste resources but also bring many technical and economic benefits, contributing to the sustainable development of related industries.
Keywords: Adsorption, modified fly ash, methylene blue.
JEL Classifications: Q56, Q57, Y10, O13, R11.
1. Mở đầu
Ô nhiễm môi trường nước do các chất hữu cơ và các chất nhuộm màu công nghiệp đã trở thành vấn đề nghiêm trọng và cấp bách hiện nay. Trong số các chất nhuộm màu thì MB là một trong những chất phổ biến nhất, thường được sử dụng trong các ngành công nghiệp dệt may, giấy và da. Không chỉ gây ô nhiễm môi trường, MB còn có thể gây hại cho sức khỏe con người khi tiếp xúc ở mức độ cao. Một trong những phương pháp hiệu quả để loại bỏ các chất nhuộm màu từ nước thải là sử dụng VLHP, trong đó, tro bay - sản phẩm phụ của quá trình đốt than tại các nhà máy nhiệt điện đã thu hút được sự chú ý, quan tâm nghiên cứu của các nhà khoa học và xem như là một VLHP tiềm năng.
Theo số liệu tổng hợp từ Tập đoàn Điện lực Việt Nam, Tập đoàn Dầu khí Việt Nam, Tập đoàn Công nghiệp Than - Khoáng sản Việt Nam và các nhà máy nhiệt điện khác, hiện cả nước có 29 nhà máy nhiệt điện đốt than đang hoạt động. Năm 2021, tổng lượng tro, xỉ phát thải từ các nhà máy nhiệt điện trên cả nước khoảng hơn 16 triệu tấn, trong đó, lượng phát thải tập trung chủ yếu ở khu vực miền Bắc (chiếm 64%); khu vực miền Trung và miền Nam chiếm tương ứng là 25% và 11% (Tập đoàn Điện lực Việt Nam, 2022). Tính đến cuối năm 2021, tổng lượng tro, xỉ nhiệt điện đã tiêu thụ cộng dồn qua các năm trên cả nước khoảng 48,4 triệu tấn, chiếm khoảng 48% tổng lượng phát thải từ trước đến nay. Ở Việt Nam, tro được sử dụng chủ yếu trong lĩnh vực xây dựng như san lấp, làm phụ gia khoáng cho xi măng, phụ gia bê tông…, trong lĩnh vực công nghiệp gia công chất dẻo hay nông nghiệp (Tập đoàn Điện lực Việt Nam, 2022).
Hầu hết các loại tro bay là các hợp chất silicat, chủ yếu bao gồm silicon dioxide (SiO2), aluminium oxide (Al2O3), iron(III) oxide (Fe2O3) và một số oxit kim loại khác như CaO, MgO, TiO2. Hàm lượng than chưa cháy chỉ chiếm một phần nhỏ so với tổng hàm lượng tro, ngoài ra còn có một số kim loại nặng như Cd, Ba, Pb, Cu, Zn... Thành phần hóa học của tro bay phụ thuộc vào nguồn nguyên liệu than đá sử dụng để đốt và điều kiện đốt cháy trong các nhà máy nhiệt điện (Lương Như Hải, 2020).
Do có diện tích bề mặt lớn, cấu trúc xốp, kích thước hạt nhỏ, thành phần hóa học đa dạng, tro bay ngày càng được các nhà khoa học quan tâm nghiên cứu với vai trò là VLHP có khả năng hấp phụ tốt các chất ô nhiễm từ môi trường và hiệu quả trong xử lý nước thải. Có nhiều báo cáo nghiên cứu sử dụng tro bay làm VLHP để loại bỏ các ion kim loại độc hại (Marisa Nascimento et al., 2012), (Dasmahapatra et al., 1996), chất gây ô nhiễm trong không khí (Anand Srinivasan et al., 1999), các hợp chất hữu cơ và vô cơ (Jakkapong Sasithorn et al., 2010), (Haribhau E. et al., 1993) và hấp phụ thuốc nhuộm trong nước thải (Nityanand Singh Maurya et al., 2008), (Debabrata Chatterjee et al., 2010). Tuy nhiên, trong tro bay, SiO2 và Al2O3 thường tồn tại dưới các dạng tinh thể khác nhau, trong đó thạch anh (SiO2) và mullite (3Al2O3 . 2SiO2) là hai dạng phổ biến và có hoạt tính hấp phụ không cao (Bakkali H. et al., 2016). Để tăng cường khả năng hấp phụ của tro bay, các phương pháp biến tính (xử lý hóa học, nhiệt hoặc cơ học) đã được áp dụng (Z. Sarbak et al., 2002), (Ubolluk Rattanasaka et al., 2009), (Xiaojing Chen et al., 2018). Nhóm tác giả Z. Sarbak và cộng sự (Z. Sarbak et al., 2002) đã xử lý bề mặt của tro bay bằng các dung dịch NaOH, NaOH/NH4HCO3, EDTA, HCl, nhằm thay đổi diện tích bề mặt, cấu trúc xốp và thành phần hóa học của tro bay. Trong tất cả mọi trường hợp, diện tích bề mặt của tro bay đã được xử lý đều lớn hơn so với mẫu tro bay ban đầu. Xiaojing Chen và cộng sự đã biến tính tro bay bằng phương pháp nung chảy - thủy nhiệt với NaOH. Kết quả nghiên cứu cho thấy, mẫu tro bay biến tính tăng diện tích bề mặt đáng kể từ 0,15 m2/g lên 270 m2/g, dung lượng hấp phụ cực đại với ion NH4+ lên đến 139 mg/g (Xiaojing Chen et al., 2018).
So với phương pháp biến tính bằng axit, biến tính tro bay bằng kiềm cho phép cải thiện đáng kể cấu trúc, tính chất bề mặt và tăng hiệu quả hấp phụ của vật liệu do liên quan đến một số phản ứng hóa học.
Thứ nhất, các hợp chất thạch anh (SiO2) và mullite (3Al2O3 . 2SiO2) trong tro bay có thể phản ứng với kiềm để tạo ra các hợp chất hòa tan:
SiO2 + 2NaOH → Na2SiO3 + H2O
3Al2O3 . 2SiO2 + 10NaOH → 2Na2SiO3 + 6NaAlO2 + 5H2O
Các phản ứng này làm giảm lượng SiO2 và Al2O3, dẫn đến sự phá hủy cấu trúc, làm tăng tính xốp và diện tích bề mặt của tro bay. Các lỗ xốp mới được hình thành giúp gia tăng khả năng hấp phụ của tro bay (Bakkali H. et al., 2016), (Tifa Paramitha, 2020).
So với phương pháp biến tính nhiệt thủy phân, phương pháp nung chảy – thủy nhiệt với NaOH rắn được thực hiện ở nhiệt độ cao hơn (550-600 oC), vì vậy có khả năng phá hủy cấu trúc tinh thể của thạch anh và mullite trong tro bay, giải phóng SiO2 và Al2O3 hoạt động. Các chất này phản ứng với NaOH và tạo ra aluminosilicat vô định hình, những tiền chất này sau đó tái tổ hợp để hình thành các cấu trúc aluminosilicat ba chiều (được gọi là geopolymer) lên bề mặt hạt tro bay trong giai đoạn thủy nhiệt. Hơn nữa, quá trình nung chảy ở nhiệt độ cao có thể loại bỏ tạp chất hữu cơ trong tro bay và cacbon vô định hình, do đó cải thiện độ tinh khiết của nguyên liệu thô. Quá trình nung chảy còn cung cấp một lượng NaOH cho quá trình thủy nhiệt tiếp theo lớn hơn nhiều so với phương pháp thủy phân trong dung dịch NaOH. Các yếu tố này làm tăng hiệu suất, chất lượng của geopolymer tạo thành, vì vậy tăng dung lượng hấp phụ của tro bay so với phương pháp nhiệt thủy phân trong dung dịch NaOH (Minghua Wang et al., 2019), (Vegere K. et al., 2020).
Thứ hai, kiềm có thể tạo ra các nhóm hydroxyl (-OH) trên bề mặt của tro bay và các nhóm -OH này có khả năng tương tác với các chất cần hấp phụ. Quá trình này giúp tăng khả năng hấp phụ của tro bay đối với những phân tử có tính acid hoặc ion dương:
R-OH (trên bề mặt) → R-OH2+ (trong môi trường kiềm)
Phân tích phổ hồng ngoại biến đổi Fourier (FTIR) đã chỉ ra sự tạo thành các liên kết O–H của silanol (Si–OH) trên bề mặt hạt tro bay thông qua các đỉnh hấp thụ ở cùng 3400-3500 cm-1 (Khoa Dang Nguyen et al., 2022).
Ở Việt Nam, các nghiên cứu ứng dụng tro bay biến tính còn hạn chế, chỉ bao gồm một số nghiên cứu như: Đánh giá khả năng hấp phụ Cu2+ trong nước thải xi mạ bằng tro bay biến tính (Lư Thị Yến và cộng sự, 2020); biến tính tro bay Phả Lại với Polyme chức năng để tăng dung lượng hấp phụ crom trong xử lý nước thải (Trần Minh Huyền, 2012); nghiên cứu tro, xỉ than và geopolymer gốc xỉ làm chất hấp phụ xử lý xanh methylen trong nước thải (Khoa Dang Nguyen et al., 2022). Hiện tại chưa có nghiên cứu nào về khả năng hấp phụ MB bằng tro TBBT theo phương pháp nung chảy - thủy nhiệt với NaOH rắn. Chính vì thế nghiên cứu này là cần thiết vì kết quả nghiên cứu là cơ sở ứng dụng tro bay biến tính trong xử lý nước thải màu có chứa MB.
2. Phương pháp thực nghiệm
2.1. Thiết bị, dụng cụ và hóa chất
Các nghiên cứu thực nghiệm được thực hiện tại phòng Thí nghiệm Môi trường - Trường Đại học Công nghệ Giao thông vận tải. Các thiết bị, máy móc thí nghiệm được trình bày trong Bảng 1.
Bảng 1: Các thiết bị thí nghiệm
|
STT |
Tên thiết bị |
Mã sản phẩm/Xuất xứ |
Chức năng chính |
|
1 |
Máy trắc quang |
Tintometer/ Pháp |
Phân tích các thành phần hóa học trong nước sử dụng phương pháp quang phổ |
|
2 |
Tủ sấy |
Memmert/Đức |
Sấy mẫu ở nhiệt độ 20 - 300oC |
|
3 |
Lò nung phá hủy mẫu |
LH 15/14 Nabertherm/Đức |
Gia nhiệt đến 1.400oC |
|
4 |
Máy đo PH |
HI 2211 Hanna/Rumania |
Đo pH của dung dịch |
|
5 |
Cân phân tích |
Sartorius/Đức |
Cân chính xác mẫu (± 0,1mg) |
|
6 |
Tủ hút khí độc |
Esco/Singapore-Indonesia |
Hút khí, hơi hóa chất trong phòng thí nghiệm |
|
7 |
Máy khuấy từ gia nhiệt |
IKA/Đức - Trung Quốc -Malaysia |
Gia nhiệt và khuấy từ |
(Nguồn: PTN Môi trường - Trường Đại học Công nghệ Giao thông vận tải)
2.1.2. Hóa chất
Các hóa chất sử dụng trong nghiên cứu bao gồm:
- Xanh methylen C16H18ClN3S
- Natri hidroxit NaOH rắn 96%
- Dung dịch HCl (36 - 38%)
Tro bay sử dụng trong nghiên cứu là tro bay của Nhà máy nhiệt điện Phả Lại, tỉnh Hải Dương, đã qua sơ tuyển bằng công nghệ thổi gió phân ly. Mẫu tro bay có diện tích bề mặt 8.169 cm2/cm3, phần lớn các hạt có kích thước 30 μm (chiếm 95%). Kết quả phân tích thành phần hóa học của mẫu tro bay tại Viện Hàn lâm khoa học và Công nghệ Việt Nam được thể hiện trong Bảng 2. Theo thành phần hóa học, tro bay của Nhà máy nhiệt điện Phả Lại thuộc nhóm F theo tiêu chuẩn ASTM C618-03 (Lư Thị Yến và cộng sự, 2020).
Bảng 2: Thành phần hoá học của tro bay sử dụng trong nghiên cứu
(% theo khối lượng)
|
SiO2 |
Al2O3 |
Fe2O3 |
CaO |
MgO |
K2O |
Na2O |
TiO2 |
SO3 |
MKN* |
|
51,74 |
24,53 |
5,59 |
0,81 |
1,95 |
4,42 |
0,11 |
0,76 |
0,31 |
8,98 |
(*) Lượng mất khi nung
(Nguồn: Lư Thị Yến và cộng sự, 2020)
2.2. Phương pháp biến tính tro bay
Phương pháp biến tính tro bay được thực hiện theo nghiên cứu (Lư Thị Yến và cộng sự, 2020). Quy trình biến tính tro bay được tiến hành như sau:
Sử dụng tro bay của Nhà máy nhiệt điện Phả Lại loại nhỏ mịn, trộn đều hỗn hợp tro bay và NaOH rắn theo tỷ lệ 1:1,2 cho vào chén sứ nung ở 600oC trong vòng 1 giờ và để nguội đến nhiệt độ phòng.
Sau khi để nguội hỗn hợp chất rắn được nghiền, thêm nước cất với tỉ lệ 1:5 rồi mang đi khuấy trên máy khuấy từ gia nhiệt và khuấy liên tục ở nhiệt độ 70oC trong vòng 2 giờ để tạo thành gel aluminosilicate. Sau đó, hỗn hợp được gia nhiệt đến 100oC trong vòng 4 giờ để thực hiện quá trình kết tinh gel aluminosilicate trên bề mặt hạt tro bay.
Để nguội hỗn hợp đến nhiệt độ phòng, lọc, rửa sạch sản phẩm bằng nước cất tới môi trường trung tính, sấy khô ở nhiệt độ 105oC và thu được mẫu tro bay biến tính. Quá trình thực nghiệm biến tính tro bay được thể hiện từ Hình 1 đến Hình 6. Mẫu tro bay thu được sau quá trình biến tính được thể hiện trên Hình 7.


2.3. Thí nghiệm xác định nồng độ MB trong dung dịch bằng phương pháp quang phổ
Pha dãy dung dịch MB với các nồng độ: 0,5 mg/l; 0,75 mg/l; 1 mg/l; 1,5 mg/l; 2 mg/l; 3 mg/l. Đo độ hấp thụ quang của dãy dung dịch chuẩn MB ở bước sóng 664 nm bằng máy trắc quang. Mỗi dung dịch đo 3 lần và lấy giá trị trung bình.
Từ số liệu độ hấp thụ quang A đo được với các dung dịch trên, xây dựng đồ thị chuẩn A - C (MB) bằng chương trình excel.
Đồ thị đường chuẩn để xác định nồng độ MB trong dung dịch được thể hiện trên Hình 8.
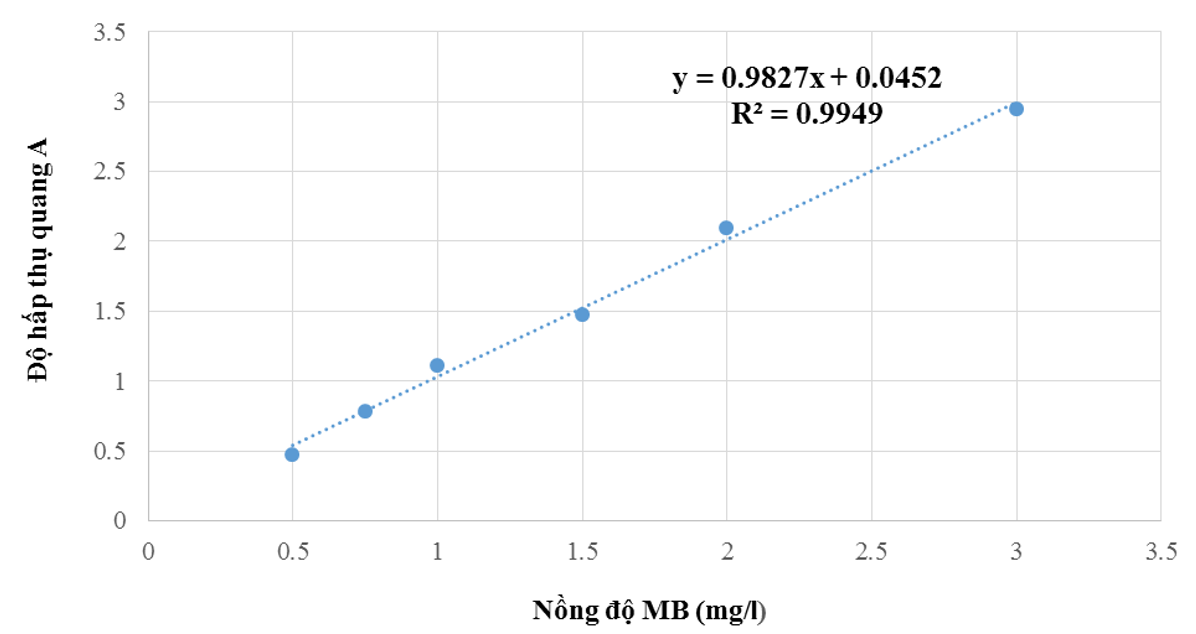
Hình 8. Đồ thị đường chuẩn để xác định nồng độ xanh methylen trong dung dịch
Từ kết quả dựng đường chuẩn xác định nồng độ MB trong dung dịch bằng phần mềm excel, ta thu được phương trình đường chuẩn: y = 0,9827x + 0,0452 với hệ số R2 = 0,9949. Hệ số R2 thu được trong khoảng nồng độ MB từ 0,5 ÷ 3 mg/l có giá trị gần bằng 1, chứng tỏ mức độ phù hợp cao của phương trình hồi quy tuyến tính thu được. Điều này đảm bảo các kết quả thu được trong quá trình xác định nồng độ MB trong nghiên cứu thực nghiệm có độ chính xác cao. Vì phương trình đường chuẩn MB có độ tuyến tính cao trong khoảng nồng độ thấp từ 0,5 ÷ 3,0 mg/l nên việc xác định các nồng độ MB ở khoảng giá trị cao hơn được thực hiện bằng cách pha loãng dung dịch cần đo.
2.4. Thí nghiệm hấp phụ MB bằng tro bay biến tính
2.4.1. Thí nghiệm nghiên cứu ảnh hưởng của thời gian tới khả năng hấp phụ MB
a. Hấp phụ MB bằng mẫu tro bay ban đầu
Lấy 7 cốc mỏ dung tích 500 ml, chứa 250 ml MB có nồng độ 40 mg/l. Cân 1g tro bay ban đầu (chưa qua xử lý) vào mỗi cốc, lắc trong các khoảng thời gian khác nhau là 5 phút, 10 phút, 15 phút, 30 phút, 60 phút, 90 phút, 120 phút. Sau đó lọc bỏ tro bay bằng giấy lọc và giữ lại dung dịch sau khi lọc. Đem dung dịch đi đo độ hấp thụ quang bằng máy trắc quang ở bước sóng 664 nm và xác định nồng độ MB còn lại dựa vào phương trình tuyến tính của đồ thị chuẩn A - C (MB).
b. Hấp phụ MB bằng mẫu tro bay biến tính
Tiến hành tương tự như trên đối với thí nghiệm hấp phụ MB bằng mẫu tro bay ban đầu, chỉ khác ở chỗ VLHP cho vào là 1g tro bay biến tính.
2.4.2. Thí nghiệm nghiên cứu ảnh hưởng của pH tới khả năng hấp phụ MB
Từ thí nghiệm nghiên cứu ảnh hưởng của thời gian tới khả năng hấp phụ MB, xác định được thời gian hấp phụ tối ưu.
Lấy 5 cốc mỏ dung tích 500 ml, chứa 250 ml MB có nồng độ 40 mg/l. Dùng dung dịch NaOH và dung dịch HCl để tạo môi trường có nồng độ pH lần lượt là: 3, 5, 7, 9, 11. Cho vào mỗi cốc 1g tro bay biến tính, lắc trong khoảng thời gian đạt cân bằng hấp phụ đã xác định ở thí nghiệm trên. Sau đó lọc bỏ tro bay bằng giấy lọc và giữ lại dung dịch sau khi lọc. Đem dung dịch đi đo độ hấp thụ quang bằng máy trắc quang ở bước sóng 664 nm (có thể pha loãng trước khi đo nếu cần). Xác định nồng độ MB còn lại dựa vào phương trình tuyến tính của đồ thị chuẩn A - C (MB).
2.4.3. Thí nghiệm nghiên cứu ảnh hưởng của nồng độ MB ban đầu tới khả năng hấp phụ
Lấy 7 cốc mỏ dung tích 500 ml, chứa 250 ml MB có nồng độ lần lượt là 40 mg/l, 50 mg/l, 75 mg/l, 100 mg/l, 150 mg/l, 200 mg/l, 250 mg/l. Cho vào mỗi cốc 1g tro bay biến tính lắc trong khoảng thời gian đạt cân bằng hấp phụ đã xác định ở thí nghiệm trên. Sau đó lọc bỏ tro bay bằng giấy lọc và giữ lại dung dịch sau khi lọc. Đem dung dịch đi đo độ hấp thụ quang bằng máy trắc quang ở bước sóng 664 nm (có thể pha loãng trước khi đo nếu cần). Xác định nồng độ MB còn lại dựa vào phương trình tuyến tính của đồ thị chuẩn A - C (MB).
2.5. Phương pháp tính toán kết quả
Tính toán dung lượng hấp phụ tĩnh
Nếu gọi Co và Ct là nồng độ chất bị hấp phụ tại thời điểm ban đầu và thời điểm t; V là thể tích dung dịch; m là khối lượng VLHP, khi đó dung lượng hấp phụ (q, mg/g) được xác định theo công thức:
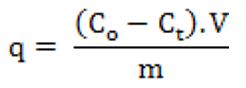
Tính toán hiệu suất hấp phụ
Hiệu suất hấp phụ được xác định theo công thức:
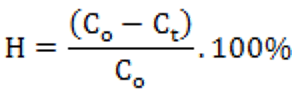
Trong đó: H là hiệu suất hấp phụ (%); Co là nồng độ dung dịch ban đầu (mg/l); Ct là nồng độ dung dịch ở thời điểm t (mg/l).
3. Kết quả nghiên cứu và thảo luận
3.1. Ảnh hưởng của thời gian tiếp xúc đến khả năng hấp phụ xanh methylen
Tiến hành khảo sát quá trình hấp phụ theo thời gian của tro bay thô ban đầu (TB) và tro bay biến tính. VLHP cho vào với tỷ lệ 1g cho 250 ml dung dịch MB, nồng độ ban đầu là 40 mg/l. Kết quả xác định nồng độ MB còn lại và và hiệu suất hấp phụ H (%) sau các khoảng thời gian nhất định được trình bày trong Bảng 3 và Hình 9, Hình 10.
Bảng 3. Kết quả khảo sát ảnh hưởng của thời gian đến khả năng hấp phụ xanh methylen bằng tro bay
|
Thời gian (phút) |
Nồng độ MB ban đầu (mg/l) |
Hấp phụ bằng TB |
Hấp phụ bằng TBBT |
||||
|
Nồng độ MB còn lại (mg/l) |
Hiệu suất hấp phụ (%) |
Dung lượng hấp phụ, q (mg/g) |
Nồng độ MB còn lại (mg/l) |
Hiệu suất hấp phụ (%) |
Dung lượng hấp phụ, q (mg/g) |
||
|
5 |
40 |
28,18 |
29,55 |
2,96 |
1,84 |
95,40 |
9,54 |
|
10 |
40 |
26,75 |
33,13 |
3,31 |
1,49 |
96,28 |
9,63 |
|
15 |
40 |
26,09 |
34,78 |
3,48 |
0,95 |
97,63 |
9,76 |
|
30 |
40 |
25,48 |
36,30 |
3,63 |
0,91 |
97,73 |
9,77 |
|
60 |
40 |
23,97 |
40,08 |
4,01 |
0,76 |
98,10 |
9,81 |
|
90 |
40 |
16,97 |
57,58 |
5,76 |
0,71 |
98,23 |
9,82 |
|
120 |
40 |
16,82 |
57,95 |
5,80 |
0,70 |
98,25 |
9,83 |
(Nguồn: Kết quả của nhóm nghiên cứu)
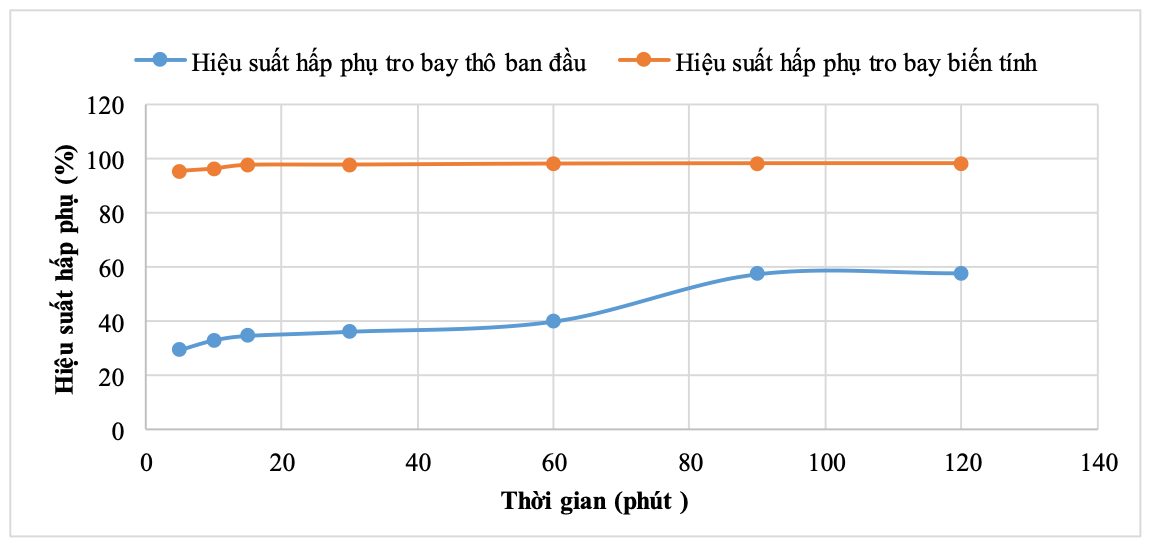
Hình 9. Kết quả khảo sát ảnh hưởng của thời gian đến hiệu suất hấp phụ MB bằng tro bay
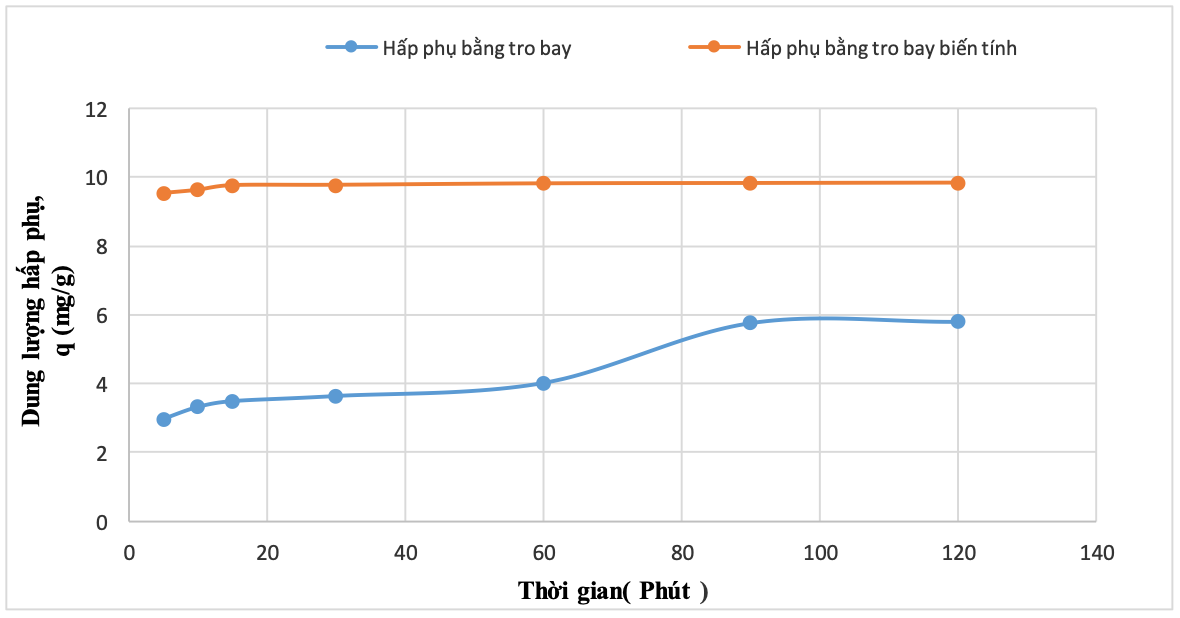
Hình 10. Kết quả khảo sát ảnh hưởng của thời gian đến dung lượng hấp phụ MB bằng tro bay
Kết quả cho thấy, mẫu tro bay thô ban đầu có khả năng hấp phụ MB trong dung dịch, tuy nhiên hiệu suất hấp phụ không cao, khoảng 30% - 58%. Hiệu suất hấp phụ tăng dần theo thời gian hấp phụ từ 5 - 120 phút. Từ phút 90, hiệu suất hấp phụ gần như ổn định cho tới 120 phút và đạt gần 58%. Dung lượng hấp phụ MB cũng tăng dần theo theo thời gian từ 2,96 mg/g tới 5,76 mg/g (ở 90 phút) và từ phút 90 trở đi thì dung lượng gần như ổn định.
Khác với mẫu TB, quá trình hấp phụ MB trên mẫu tro bay biến tính diễn ra khá nhanh và hiệu quả cao, chỉ sau 5 phút, hiệu suất hấp phụ đã đạt 95,4%. Hiệu suất hấp phụ tăng khi thời gian tiếp xúc giữa tro bay biến tính và MB tăng lên, tuy nhiên tăng không đáng kể. Kể từ phút 60 - phút 120, hiệu suất hấp phụ gần như không thay đổi và hiệu suất rất cao, lên tới 98,25%. Dung lượng hấp phụ MB bằng TBBT cũng tăng đáng kể so với mẫu TB thô ban đầu. Dung lượng hấp phụ đạt 9,84mg/g ở 120 phút.
Điều này được giải thích là do quá trình biến tính bằng NaOH đã có tác dụng thay đổi hình thái và làm tăng diện tích bề mặt hạt tro bay, do đó, làm tăng khả năng tiếp xúc và khả năng tương tác của MB với các tâm hấp phụ trên bề mặt hạt tro bay, dẫn đến việc tăng hiệu suất hấp phụ so với mẫu tro bay thô ban đầu (Sarbak Z. et al., 2002), (Xiaojing Chen et al., 2018), (Lư Thị Yến và cộng sự, 2020). Vì vậy, các thí nghiệm tiếp theo chỉ tiến hành khảo sát quá trình hấp phụ MB trên tro bay biến tính.
Dựa vào kết quả khảo sát ảnh hưởng của thời gian tiếp xúc đến hiệu suất xử lý, có thể xác định thời gian quá trình hấp phụ đạt trạng thái cân bằng là khoảng 90 phút. Kết quả này tương tự với nghiên cứu hấp phụ Cu2+ trên mẫu tro bay biến tính bằng phương pháp nung chảy - thủy nhiệt (Lư Thị Yến và cộng sự, 2020) và bằng ½ thời gian hấp phụ MB trên mẫu tro, xỉ than biến tính bằng dung dịch NaOH/Na2SiO3 ở 60oC trong 24h (Khoa Dang Nguyen và cộng sự, 2022). Điều này có ý nghĩa trong thực tế vì rút ngắn thời gian xử lý nước thải ở công đoạn hấp phụ.
Các thí nghiệm tiếp theo được tiến hành với thời gian hấp phụ 90 phút.
3.2. Ảnh hưởng của pH đến khả năng hấp phụ MB
Khảo sát ảnh hưởng của pH đến khả năng hấp phụ MB trong dung dịch của mẫu tro bay biến tính được thực hiện với các tham số: Khối lượng tro bay biến tính là 1g; thể tích dung dịch MB là 250 ml; nồng độ MB là 40 mg/l; thời gian hấp phụ 90 phút. Khoảng pH khảo sát từ 3÷11, bao gồm các giá trị 3, 5, 7, 9, 11. Giá trị pH của dung dịch được điều chỉnh bằng cách sử dụng dung dịch HCl và NaOH. Dung dịch MB sau khi hấp phụ bằng tro bay biến tính ở các giá trị pH khác nhau, thể hiện trong Hình 11.

Hình 11. Dung dịch xanh methylen sau khi hấp phụ bằng TBBT ở các khoảng giá trị pH khác nhau
Kết quả khảo sát hiệu suất hấp phụ MB trên mẫu tro bay biến tính theo các giá trị pH khác nhau của dung dịch được biểu diễn trong Bảng 4 và Hình 12, Hình 13.
Bảng 4. Kết quả khảo sát ảnh hưởng của pH đến khả năng hấp phụ MB của TBBT
|
pH |
Nồng độ MB ban đầu, Co (mg/l) |
Nồng độ MB còn lại, Ct (mg/l) |
Hiệu suất hấp phụ, H (%) |
Dung lượng hấp phụ, q (mg/g) |
|---|---|---|---|---|
|
3 |
40 |
1,24 |
96,90 |
9,69 |
|
5 |
40 |
1,16 |
97,10 |
9,71 |
|
7 |
40 |
0,59 |
98,53 |
9,85 |
|
9 |
40 |
0,82 |
97,95 |
9,80 |
|
11 |
40 |
2,71 |
93,23 |
9,32 |
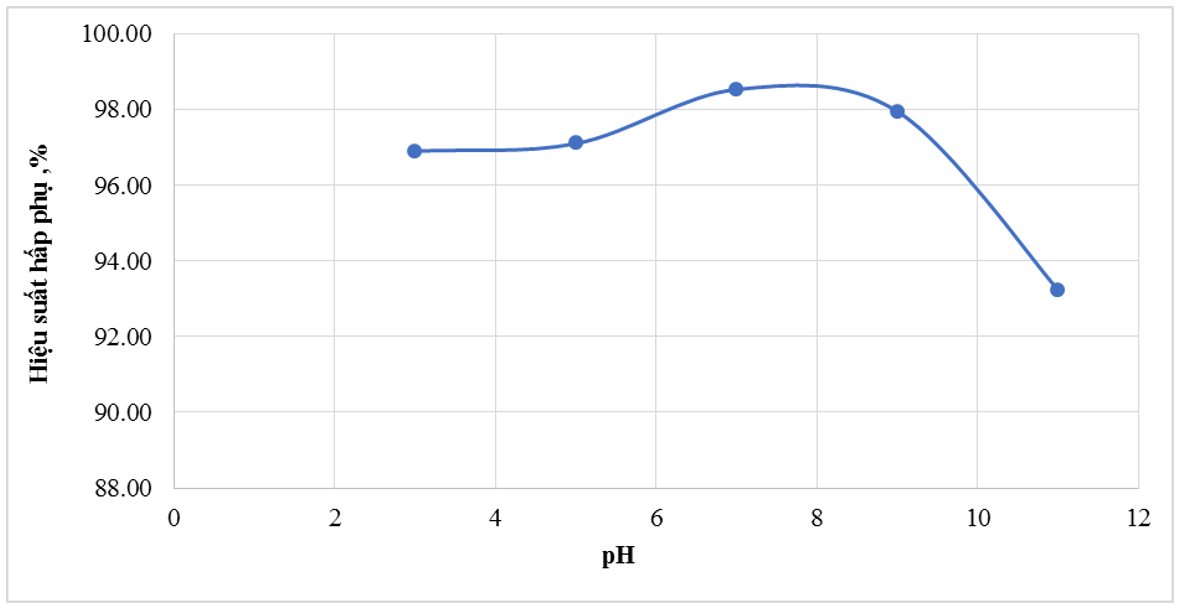
Hình 12. Ảnh hưởng của pH tới hiệu suất hấp phụ MB của TBBT
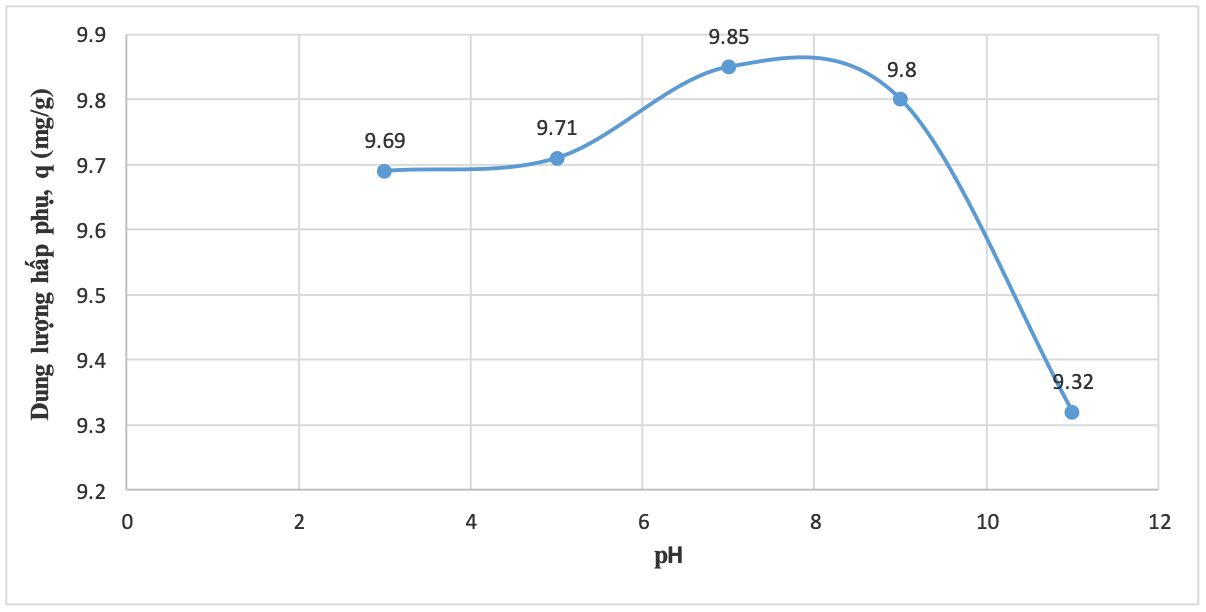
Hình 13. Ảnh hưởng của pH tới dung lượng hấp phụ MB của TBBT
Từ kết quả Bảng 4 cho thấy, hiệu suất và dung lượng hấp phụ MB có sự thay đổi theo pH của dung dịch. Tro bay biến tính hấp phụ MB tốt nhất ở môi trường pH = 7 với hiệu suất hấp phụ 98,53% và dung lượng hấp phụ là 9,85mg/g. Khả năng hấp phụ MB tăng dần khi môi trường từ axit tới trung tính và hơi kiềm, tuy nhiên, khi pH tăng quá cao thì hiệu suất lại giảm chỉ còn 93,23% (pH = 11). Kết quả này có sự khác biệt với nghiên cứu (Lư Thị Yến và cộng sự, 2020) khi hiệu suất hấp phụ Cu2+ bằng tro bay biến tính lại đạt hiệu suất cao nhất ở pH = 6 (H = 95%). Điều này là do pH thấp, các nhóm chức trên bề mặt tro bay (như nhóm hydroxyl-OH) có thể bị proton hóa, dẫn đến bề mặt mang điện tích dương, gây lực đẩy tĩnh điện đối với cation MB+, làm giảm khả năng hấp phụ. Ở pH trung tính, tro bay có thể có bề mặt gần như trung tính về điện tích hoặc có một số vị trí mang điện tích âm. Sự hấp phụ của MB có thể đạt mức tối ưu do cân bằng giữa các lực tĩnh điện và tương tác Vander Waals. Ở pH hơi kiềm, các nhóm chức trên bề mặt tro bay có thể bị deproton hóa, dẫn đến bề mặt mang điện tích âm, tạo điều kiện thuận lợi cho sự hấp phụ cation MB+ do lực hút tĩnh điện mạnh hơn. Tuy nhiên nếu pH tiếp tục tăng cao (pH =11) thì có sự cạnh tranh của các ion OH- có trong dung dịch nên hiệu suất hấp phụ lại giảm dần.
Mặc dù pH có ảnh hưởng đến hiệu suất hấp phụ, nhưng không đáng kể và hiệu suất hấp phụ vẫn rất cao trong khoảng pH từ 3 - 11, điều này rất có ý nghĩa trong thực tế vì có thể xử lý hiệu quả nguồn nước ô nhiễm màu MB với các khoảng pH khác nhau.
3.3. Ảnh hưởng của nồng độ MB ban đầu tới khả năng hấp phụ
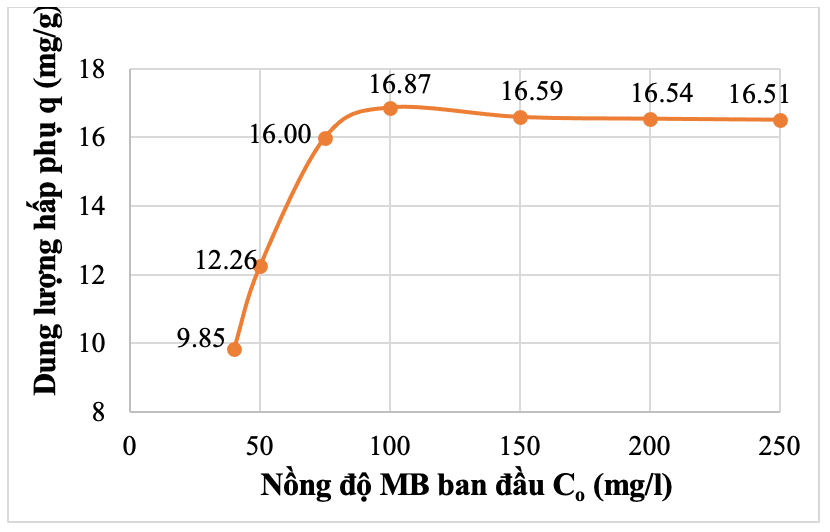
Tiến hành khảo sát khả năng hấp phụ MB với các nồng độ MB ban đầu 40 mg/l, 50 mg/l, 75 mg/l, 100 mg/l, 150 mg/l, 200 mg/l, 250 mg/l; lượng tro bay biến tính được giữ nguyên là 1 g, thể tích dung dịch MB là 250 ml; pH = 7 và thời gian hấp phụ là 90 phút. Kết quả khảo sát được xác định và trình bày trong Bảng 5 và Hình 14, Hình 15.
Bảng 5. Kết quả khảo sát ảnh hưởng nồng độ MB đến khả năng hấp phụ của TBBT
|
Khối lượng tro bay biến tính, m (g) |
Thể tích dung dịch MB, V(ml) |
Nồng độ MB ban đầu, Co (mg/l) |
Nồng độ MB còn lại, Ct (mg/l) |
Hiệu suất hấp phụ, H (%) |
Dung lượng hấp phụ, q (mg/g) |
|---|---|---|---|---|---|
|
1 |
250 |
40 |
0,59 |
98,53 |
9,85 |
|
1 |
250 |
50 |
0,96 |
98,08 |
12,26 |
|
1 |
250 |
75 |
11,01 |
85,32 |
16,00 |
|
1 |
250 |
100 |
32,53 |
67,47 |
16,87 |
|
1 |
250 |
150 |
83,64 |
44,24 |
16,59 |
|
1 |
250 |
200 |
133,84 |
33,08 |
16,54 |
|
1 |
250 |
250 |
183,96 |
26,42 |
16,51 |
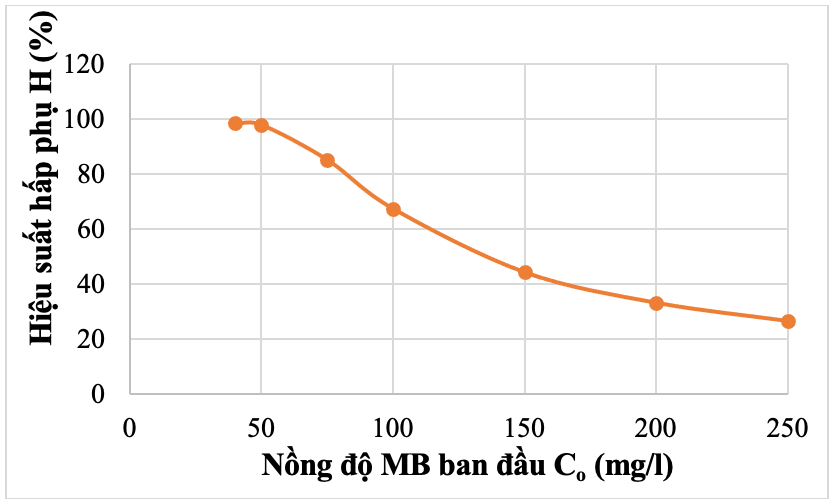
Hình 14. Ảnh hưởng nồng độ MB đến hiệu suất hấp phụ của TBBT
Hình 15. Ảnh hưởng nồng độ MB đến dung lượng hấp phụ của TBBT
Từ Bảng 5 cho thấy, khi nồng độ MB tăng thì hiệu suất hấp phụ giảm. Với trường hợp nồng độ thấp, Co= 40 mg/l, hiệu suất hấp phụ đạt tới 98,53%, nhưng khi tăng nồng độ dung dịch MB lên 250mg/l thì hiệu suất giảm chỉ còn 26,42%, trong khi đó, giá trị dung lượng hấp phụ q tăng dần theo chiều tăng của nồng độ MB. Tuy nhiên, dung lượng hấp phụ tăng từ 9,85 mg/g lên 16,87 mg/g khi nồng độ tăng từ 40 mg/l lên 100mg/l và khi tăng tiếp nồng độ MB lên các giá trị 150 mg/l, 200 mg/l, 250 mg/l, dung lượng hấp phụ gần như không đổi. Điều này có thể được giải thích, khi nồng độ MB tăng, số lượng phân tử MB có sẵn để tương tác với các vị trí hấp phụ trên bề mặt tro bay cũng tăng, dẫn đến sự gia tăng ban đầu trong khả năng hấp phụ. Tuy nhiên, khi tất cả các vị trí hấp phụ trên bề mặt tro bay đã bị lấp đầy, quá trình hấp phụ sẽ đạt đến trạng thái cân bằng, sau điểm này, việc tăng nồng độ MB sẽ không làm tăng đáng kể lượng MB hấp phụ.
3.4. Mô hình đẳng nhiệt hấp phụ MB bằng TBBT
Các mô hình đẳng nhiệt Langmuir và Freundlich được sử dụng nhiều nhất để giải thích quá trình hấp phụ (Yuan N. et al., 2029).
Phương trình hấp phụ đẳng nhiệt Langmuir:
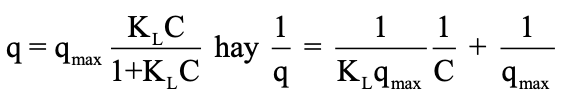 (1)
(1)
Trong đó: C là nồng độ cân bằng của MB trong dung dịch, mg/l; KL là hằng số hấp phụ Langmuir (l/mg); qmax là dung lượng hấp phụ cực đại (mg/g); q là dung lượng hấp phụ tại thời điểm cân bằng (mg/g).
Phương trình hấp phụ đẳng nhiệt Freundlich:
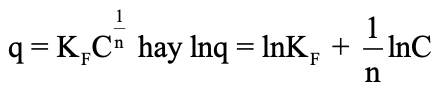 (2)
(2)
Trong đó: q là dung lượng hấp phụ tại thời điểm cân bằng (mg/g); C là nồng độ của MB ở thời điểm cân bằng, mg/l; KF và 1/n là các hằng số hấp phụ Freundlich.
Vì KL, qmax, KF và n là các hằng số nên phương trình (1) và (2) có dạng đường thẳng y = ax+b. Biểu diễn số liệu thực nghiệm sự phụ thuộc của 1/q vào 1/C theo phương trình Langmuir (phương trình 1) và lnq vào lnC theo phương trình Freundlich (phương trình 2) ta được các đồ thị trên Hình 16 và Hình 17.
|
|
|
|
Hình 16. Sự phụ thuộc 1/q vào 1/C theo mô hình đẳng nhiệt Langmuir |
Hình 17. Sự phụ thuộc lnq vào lnC theo mô hình đẳng nhiệt Freundlich |
Từ phương trình tuyến tính trên đồ thị Hình 16 và Hình 17 ta tính được giá trị các hằng số trong các phương trình đẳng nhiệt (1) và (2) (Bảng 6).
Bảng 6. Giá trị các hằng số và hệ số tương quan của phương trình đẳng nhiệt Langmuir và Freundlich đối với sự hấp phụ MB bằng TBBT
|
Mô hình đẳng nhiệt Langmuir |
Mô hình đẳng nhiệt Freundlich |
||||
|
qmax |
KL |
R2 |
n |
KL |
R2 |
|
16,8 |
2,5 |
0,9915 |
12,4 |
11,7 |
0,8126 |
(Nguồn: Kết quả của nhóm nghiên cứu)
Từ số liệu Bảng 6 ta thấy, giá trị hệ số tương quan R2 của phương trình Langmuir khá cao (bằng 0,9915) và lớn hơn giá trị R2 của phương trình Freundlich. Điều đó chứng tỏ sự hấp phụ MB trên TBBT phù hợp với mô hình đẳng nhiệt Langmuir: Sự hấp phụ MB lên TBBT là sự hấp phụ đơn lớp, năng lượng của các tâm hấp phụ trên bề mặt TBBT là đồng nhất và các phân tử MB bị hấp phụ trên bề mặt hạt TBBT không tương tác với nhau. Dung lượng hấp phụ tối đa được tính toán từ phương trình đẳng nhiệt Langmuir là 16,8 mg/g (Bảng 6). Kết quả này cũng khá tương đồng với dung lượng hấp phụ tối đa Cu2+ của tro bay biến tính là 16,4 mg/g trong một nghiên cứu trước đó (Lư Thị Yến và cộng sự, 2020).
4. Kết luận
Dựa vào kết quả nghiên cứu thực nghiệm, có thể rút ra kết luận về khả năng hấp phụ MB bằng tro bay biến tính như sau:
(1) Tro bay của nhà máy nhiệt điện Phả Lại, tỉnh Hải Dương sau khi xử lý biến tính bằng NaOH rắn 96% ở 600oC trong 1 giờ có khả năng hấp phụ MB tốt hơn so với TB chưa biến tính rất nhiều.
(2) Nghiên cứu được một số yếu tố ảnh hưởng đến khả năng hấp phụ MB bằng tro bay biến tính theo phương pháp hấp phụ tĩnh cho kết quả:
- Thời gian để quá trình hấp phụ đạt trạng thái cân bằng là khoảng 90 phút.
- Tại khoảng pH từ 3 - 11 đều đạt hiệu suất hấp phụ cao (trên 93%) và tro bay biến tính hấp phụ MB tốt nhất ở môi trường pH = 7 (hiệu suất hấp phụ 98,53%).
- Hiệu suất hấp phụ cao (hơn 98%) ở nồng độ MB ban đầu là 40 mg/l và 50 mg/l. Khi tăng nồng độ MB, hiệu suất hấp phụ giảm dần và chỉ còn 26,42% nếu nồng độ MB là 250 mg/l. Giá trị dung lượng hấp phụ tăng dần theo chiều tăng dần nồng độ MB, tuy nhiên, dung lượng hấp phụ chỉ tăng đến 16,87 mg/g (khi nồng độ MB là 100 mg/l) rồi dần ổn định.
(3) Sự hấp phụ MB lên TBBT phù hợp với mô hình đẳng nhiệt Langmuir. Dung lượng hấp phụ tối đa được tính toán từ đường đẳng nhiệt Langmuir là 16,8 mg/g.
Như vậy, kết quả nghiên cứu cho thấy, tro bay biến tính là một loại VLHP có khả năng hấp phụ MB rất tốt, có thể ứng dụng vào xử lý nước thải. Tuy nhiên nghiên cứu này mới chỉ dừng lại ở quá trình hấp phụ tĩnh với mẫu dung dịch MB pha chế trong phòng thí nghiệm và chưa có thí nghiệm hoàn nghiên VLHP. Vì cần tiếp tục nghiên cứu về quá trình hấp phụ động trên cột, hoàn nguyên VLHP và nghiên cứu trên các mẫu nước thải màu công nghiệp để đánh giá được hiệu quả sử dụng TBBT trong thực tế.
ThS. Phạm Thị Ngọc Thùy1, TS. Lư Thị Yến1, ThS. Nguyễn Thị Thu Cúc1
1Trường Đại học Công nghệ Giao thông vận tải
(Nguồn: Bài đăng trên Tạp chí Môi trtrường số Chuyên đề tiếng Việt II/2024)
TÀI LIỆU THAM KHẢO
1. https://www.evn.com.vn/d6/news/Tiep-tuc-thuc-cac-Bo-nganh-tim-giai-phap-xu-ly-tro-xi-thai-cua-cac-nha-may-nhiet-dien-phan-bon-6-8-30544.aspx
2. Lương Như Hải (2020), Các đặc trưng của tro bay, Tạp chí Công nghiệp môi trường, https://congnghiepmoitruong.vn/cac-dac-trung-cua-tro-bay-5960.html.
3. Marisa Nascimento, Patrícia F. Prado, Paulo Sérgio M. Soares and Vicente P. de Souza, Thermodynamic Study of theSynthesis of Zeolites from Coal Ash andIts Use as Sorbents for Heavy Metals, Ion Exchang Techonlogies, 2012.
4. Dasmahapatra G. P., Pal T. K., Bhadra A. K., Bhattacharya B., Studies on separation characteristics of hexavalentchromium from aqueous solution by fly ash, Separation scienceandtechnology, 1996, 31 (14), 2001 - 2009.
5. Anand Srinivasan and Michael W. Grutzeck, The Adsorption of SO2 by Zeolites Synthesized from Fly Ash, Environ. Sci. Technol, 1999, 33 (9), 1.464 - 1.469
6. Jakkapong Sasithorn, Dawan Wiwattanadate and Supin Sangsuk, Utilization of Fly Ash from Power Plant for Adsorption of Hydrocarbon Contamination in Water, Journal of Metals, Materials andMinerals, 2010, 20 (1), 5 - 10.
7. Haribhau E., Upadhya Y., and Upadhya S N., Removal of phenols from effluents by fly ash, Int J Environ. Studies, 1993, 43, 169 - 176.
8. Nityanand Singh Maurya, Atul Kumar Mittal and Peter Cornel, Evaluation of adsorption potential of adsorbents: A case of uptake of cationic dyes, Journal of Environmental Biology, 2008, 29(1), 31-36.
9. Debabrata Chatterjee, Vidya Rupini Patnam, Anindita Sikdar, and S. K. Moulik, Removal of Some Common Textile Dyes from Aqueous Solution Using Fly Ash, J. Chem. Eng. Data, 2010, 55 (12), 5.653 - 5.657.
10. H. Bakkali, M. Ammari, I. Frar, NaOH alkali-activated class F fly ash: NaOH molarity, Curing conditions and mass ratio effect, J. Mater. Environ. Sci., 2016, 7 (2), 397-401.
11. Ubolluk Rattanasaka, Prinya Chindaprasirt. Influence of NaOH solution on the synthesis of fly ash geopolymer, Minerals Engineering, 2009, 22 1073–1078.
12. Z. Sarbak, M. Kramer-Wachowiak, Porous structure of waste fly ashesand their chemical modifications, Powder Technology, 2002, 123, 53 - 58.
13. Xiaojing Chen, Huiping Song, Yanxia Guo et al, Converting waste coal fly ash into effective adsorbent for the removal of ammonia nitrogen in water. Journal of Materials Science, 2018, 53, 12.731 - 12.740.
14. Tifa Paramitha, Conversion of Coal Fly Ash to Zeolite by Alkaline Fusion-Hydrothermal Method: A Review. Advances in Engineering Research, 2020, vol. 198.
15. Minghua Wang, Hui Zhao, Gulambar Tursun et al, Melting and dissolving fly ash by NaOH for the removal of iron, calcium and other impurities, Academia Journal of Scientific Research, 2019, 7 (11).
16. K. Vegere, R. Kravcevica, A.E. Krauklis, T. Juhna, Comparative study of hydrothermal synthesis routes of zeolite, A. Mater. Today Proc., 2020, 33, pp. 1984-1987.
17. Khoa Dang Nguyen, Quynh Nguyen Vo My, Anh Phan Thi Kim et al. Coal fly ash-slag and slag-based geopolymer as an absorbent for the removal of methylene blue in wastewater. Science & Technology Development Journal, 2022, 25 (1): 2.215 - 2.223.
18. Lư Thị Yến, Trịnh Hoàng Sơn, Nguyễn Thị Phương Dung, Nghiên cứu khả năng ứng dụng tro bay biến tính trong xử lý nước thải nhiễm đồng, Tạp chí Môi trường, Chuyên đề II, năm 2020.
19. Trần Minh Huyền, Nghiên cứu biến tính tro bay Phả Lại với Polyme chức năng để tăng cường dung lượng hấp phụ crom ứng dụng xử lý nước thải, luận văn thạc sĩ, trường Đại học Khoa học tự nhiên, 2012.
20. Yuan N, Cai H, Liu T, Huang Q, Zhang X (2019) Adsorptive removal of methylene blue from aqueous solution using coal fly ash-derived mesoporous silica material. Adsorpt Sci Technol, 2019, 37(3–4) : 333–348.