

17/10/2022
Tóm tắt: Trong nghiên cứu này chúng tôi khảo sát ảnh hưởng của các anion (Cl-, NO3-, SO42-, HCO3-, HPO42-, CO32- ở nồng độ 5 mM, 15 mM) và nền mẫu nước sinh hoạt đến hiệu quả loại bỏ Rhodamin B bởi quá trình hoạt hóa PMS bởi xúc tác CoFe-LDH ở điều kiện tối ưu [RhB] = 70 mg/L; [Xúc tác] = 50 mg/L; [PMS] = 500 mg/L; Nhiệt độ = 30oC. Khi sử dụng nước cất hai lần, sau 5 phút phân hủy được 99,095% RhB. Kết quả cho thấy sự có mặt của các anion ở nồng độ thấp (5 mM), mức độ ảnh hưởng anion như sau: NO3- » Cl- » SO42- < HPO42- < HCO3- » CO32-, khi tăng nồng độ anion 15 mM, thứ tự tăng dần về khả năng ức chế sự phân hủy Rhodamin B như sau: NO3- < SO42- < Cl- < HPO42- < HCO3- » CO32-. Sự có mặt của các nền mẫu nước sinh hoạt (Nước thải sinh hoạt, nước Hồ Tây, nước thải công ngiệp sau xử lý) đều làm phân hủy hoàn toàn Rhodamin B. Trong đó, nước thải sinh hoạt, nước Hồ Tây làm tăng cường tốc độ phân hủy và giảm thời gian xử lý. Với nước sông Tô Lịch làm ức chế sự phân hủy Rhodamin B đạt 50,94% sau 5 phút.
Từ khóa: CoFe-LDH, hydroxit lớp kép, phương pháp đồng kết tủa, PMS, gốc sunphat.
Nhận bài:31/8/2022; Sửa chữa: 14/9/2022; Duyệt đăng: 20/9/2022.
1. Giới thiệu
Khoảng 10 - 20% tổng sản lượng thuốc nhuộm được thải ra từ ngành công nghiệp dệt may và các hoạt động công nghiệp khác đã làm ra gia tăng mối nguy hiểm cho môi trường do không phân hủy sinh học, độc tính cao và khả năng gây ung thư. Trong đó, Rhodamin B là thuốc nhuộm cation, sử dụng phổ biến trong ngành công nghiệp dệt nhuộm do tính bền màu và giá thành rẻ [1]. Những nỗ lực đáng kể đã được thực hiện để phát triển các công nghệ tiên tiến để xử lý nước thải bị ô nhiễm bởi thuốc nhuộm. Hiện nay, việc sử dụng các quá trình ô xy hóa tiên tiến (AOP) trên cơ sở gốc sunfat (SO4·-) đã được đề xuất như một cách để phân hủy các chất ô nhiễm hữu cơ nguy hại trong môi trường nước nhờ tính ô xy hóa cao (Eo =2,5 - 3,1 V), hằng số tốc độ phân hủy các chất ô nhiễm cao 106 - 109 M-1.s-1, khoảng pH xử lý rộng (pH = 2 - 8) [2]. Gốc sunphat có thể hình thành từ quá trình hoạt hóa peroxymonosulfate (PMS) bằng các tác nhân khác nhau như kim loại chuyển tiếp, nhiệt, siêu âm, bức xạ tử ngoại, vi sóng. Trong đó, hoạt hóa PMS bằng cách sử dụng xúc tác dị thể trên cơ sở kim loại chuyển tiếp (Fe, Co, Cu và Mn) có nhiều ưu điểm do khả năng tái sử dụng của chất xúc tác và dễ dàng tách chất xúc tác đã qua sử dụng khỏi môi trường phản ứng, đồng thời không cần cung cấp năng lượng cho quá trình hoạt hóa [1].
Trong điều kiện thực tế, quá trình ô xy hóa thuốc nhuộm bởi các gốc tự do có thể bị ảnh hưởng bởi anion của nước thực (Cl-, SO42-, NO3-, HCO3-, HPO42-, CO32-) và thành phần của nước thải dệt nhuộm, các anion này có thể hoạt động như một chất dập tắt gốc tự do để hình thành các gốc tự do có tính ô xy hóa yếu hơn. Trong nghiên cứu của Bo Sheng và cộng sự, sự có mặt của anion Cl- (<1 mM) làm giảm hiệu quả phân hủy của thuốc nhuộm axit dacam 7 (AO7) do phản ứng dập tắt gốc tự do, tuy nhiên, khi hàm lượng Cl- lớn hơn 1 mM làm tăng tốc độ phân hủy của thuốc nhuộm AO7 bởi phản ứng trực tiếp của Cl- với PMS hình thành các dạng hoạt động của clo (Cl2 và HClO), thúc đẩy phản ứng phân hủy AO7. Điều này cũng quan sát thấy, khi có mặt anion photphat [3], Minghua Nie và cộng sự chỉ ra sự có mặt của CO32- ở nồng độ thấp (0,5 mM và 5 mM), gây ức chế sự phân hủy AO7, sự tăng cường phân hủy AO7 được quan sát ở nồng độ CO32- (> 5 mM), do tăng pH dung dịch đến 11.4, thúc đẩy sự hoạt hóa PMS trong môi trường kiềm. Sự có mặt của các anion HCO3-, HPO42- làm ức chế mạnh sự loại bỏ AO7 [4], kết quả này cũng được quan sát trong công bố của Liuyang Xu [5].
Trong những nghiên cứu trước đây [6,7], chúng tôi đã tổng hợp thành công vật liệu CoFe-LDH, khảo sát điều kiện tối ưu đến khả năng hoạt hóa PMS và chọn điều kiện tối ưu cho hệ CoFe-LDH/PMS/RhB là [RhB] = 70 mg/L; [Xúc tác] = 50 mg/L; [PMS] = 500 mg/L; Nhiệt độ = 30oC. Trên cơ sở điều kiện tối ưu này, chúng tôi tiến hành nghiên cứu ảnh hưởng của các anion (Cl-, SO42-, NO3-, HCO3-, HPO42-, CO32-) và thành phần nước mặt (nước sông, hồ), nước thải đến hiệu quả phân hủy Rhodamin B bởi hệ CoFe-LDH/PMS.
2. Phương pháp nghiên cứu
2.1. Thiết bị, dụng cụ và hóa chất
Hóa chất sử dụng trong nghiên cứu đều thuộc loại tinh khiết: Oxon (Kali Peroxymonosunphat hãng Macklin (Trung Quốc); Co(NO3)2.6H2O, Fe(NO3).9H2O, H2SO4, NaOH, Na2SO4, Na2CO3, NaNO3, NaCl, Na2HPO4, NaHCO3 độ tinh khiết 99% (hãng Xilong - Trung Quốc); Ethanol độ tinh khiết 99% của hóa chất Đức Giang, Việt Nam. Rhodamin B (RhB) độ tinh khiết 99% của hãng Himedia, Ân Độ. Thiết bị UV-Vis Labomed, Mỹ được sử dụng để phân tích nồng độ RhB tại các thời điểm khác nhau ở bước sóng λmax = 554 nm, sử dụng cuvet thạch anh có bề dày 1,0 cm; Thiết bị phá mẫu COD Aqualytic AL38 (70 - 150)oC , Tomax = 150oC; Máy đo pH Hana HI9812-5.
2.2. Quy trình thử nghiệm hoạt hóa
Quá trình hoạt hóa PMS bởi xúc tác CoFe-LDH được thực hiện trong bình định mức 5 mL. Đầu tiên, huyền phù CoFe-LDH, RhB và PMS với nồng độ lần lượt là 1.000, 100 và 5.000 mg/L được chuẩn bị bằng cách phân tán lượng cân của hóa chất tương ứng trong nước cất hai lần bằng cách sử dụng bình định mức. Lấy 1,75 mL dung dịch RhB 200 mg/L vào bình định mức 5 mL, 0,25 mL CoFe-LDH, sau đó lắc trong 30 phút cho đến khi đạt cân bằng hấp phụ - giải hấp phụ, thêm các anion (Cl-, SO42-, NO3-, HCO3-, HPO42- và CO32-) ở nồng độ 0 mM, 5 mM, 15 mM, sau đó thêm tiếp 0,5 mL dung dịch PMS và định mức đến vạch. pH của dung dịch được điều chỉnh bằng cách thêm từ từ từng giọt NaOH hoặc H2SO4 0,01 M. Dung dịch so sánh cũng được chuẩn bị tương tự như trên nhưng không có RhB. Độ hấp thụ quang của dung dịch RhB theo thời gian được đo tại bước sóng 554 nm[8, 9]. Các thí nghiệm được lặp lại 3 lần, tính kết quả trung bình và độ lệch chuẩn. Hiệu quả phân hủy của Rhodamin B được tính qua biểu thức 1:
H% = 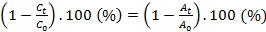 (1)
(1)
Ở đây, Co và Ao là nồng độ và độ hấp thụ quang tương ứng của RhB ở thời điểm ban đầu Ct and At nồng độ và độ hấp thụ quang tương ứng của RhB ở thời điểm t.
Mẫu nước mặt được lấy theo TCVN 6663-1:2011, TCVN 5999:1995, TCVN 6663-3:2016, SMEWW 1060:2017. Các thông số được tiến hành phân tích theo TCVN hoặc SMEWW như pH (TCVN 6429:2011), SO42- (SMEWW 4500-SO42-E:2017), Cl- (TCVN 6194 :1996), NO3- (TCVN 6179-1:1996), CO32- (SMEWW 2320B-2012), HCO3- (SMEWW 2320B-2012), NH4+ (TCVN 6180:1996) và COD (SMEWW 5220C:2017).

Hình 1. Một số mẫu nước thực nghiệm
Vị trí lấy mẫu:
Sông Tô Lịch: Nước sông Tô Lịch đoạn Quan Hoa, Hà Nội;
Nước thải sinh hoạt: Nước tại cống thoát nước Khu đô thị Green star, Hà Nội.
Nước Hồ Tây: Nước Hồ Tây đoạn cổng chào Lạc Long Quân, Tây Hồ, Hà Nội.
Nước thải sau xử lý: Nước thải sau xử lý tại trạm 2.200 m3/ngày, đêm, Công ty TNHH Youngone Nam Định, Khu công nghiệp Hòa Xá, tỉnh Nam Định.
3. Kết quả và thảo luận
3.1. Ảnh hưởng của các anion Cl-, NO3- và SO42-
Chúng tôi tiến hành nghiên cứu sự ảnh hưởng của các anion Cl-, NO3- và, SO42-, ở nồng độ 0 mM, 5 mM và 15 mM đến quá trình phân hủy RhB bởi hệ CoFe-LDH/PMS. Quá trình khảo sát trong điều kiện thí nghiệm [RhB] = 70 mg/L; [Xúc tác] = 50 mg/L; [PMS] = 500 mg/L; [Anion] = 0 - 15 mM, nhiệt độ = 30oC. Kết quả được biểu thị trên Hình 2.
Hình 2. Ảnh hưởng của các anion Cl-, NO3- và SO42- đến sự phân hủy RhB trong hệ CoFe-LDH/PMS
Từ Hình 2 cho thấy, khi không thêm các anion, sau 5 phút hiệu quả phân hủy RhB là 99,045%. Khi có mặt anion Cl- ở nồng độ 5 mM, 15 mM thì sau 5 phút hiệu quả xử lý RhB giảm nhẹ từ 94,6 - 84,2% (Hình 2a). Sự ức chế quá trình phân hủy RhB khi có mặt anion Cl- có thể được giải thích do Cl- có thể phản ứng trực tiếp với PMS để tạo ra HOCl, Cl2 (phản ứng 1 và 2) [10, 11]. Mặt khác, SO4●- và HO● được tạo ra bằng cách kích hoạt PMS cũng có thể cung cấp các điện tử tự do cho Cl- để tạo thành các gốc Cl●, Cl2●, ClOH●- (phản ứng 3 - 5), k(SO4●-- Cl−) = 2,0 × 108 M-1s-1, k(HO●-Cl−) = 4,3 × 109 M-1s-1) [12]. Thêm nữa, EoClOH●-/Cl- = 1,5 - 1,8V; EoCl●-/Cl- = 2 V thấp hơn thế ô xy hóa khử của các gốc sunphat (Eo = 2,5 - 3,1 V) và hydroxyl (Eo = 1,8 - 2,8 V) là nguyên nhân dẫn đến giảm tốc độ loại bỏ RhB khi có mặt ion Cl- [13].
|
Cl- + HSO5- → SO42- + HOCl |
(1) |
|
2Cl- + HSO5- + H+ → SO42- + Cl2 + H2O |
(2) |
|
SO4●- + Cl- → SO42- + Cl● |
(3) |
|
Cl● + Cl- → Cl2●- |
(4) |
|
Cl-+ HO● → ClOH●- |
(5) |
Hình 2b cho thấy, anion NO3‑ ức chế nhẹ sự phân hủy RhB ở nồng độ 1 mM và 15 mM (hiệu quả phân hủy tương ứng là 98,2 và 90,4%), nguyên nhân nitrat có thể dập tắt các gốc hydroxyl, sunphat, tạo ra các gốc nitrat (NO3● ) (phản ứng 6 - 7) có thế ô xy hóa khử cao (Eo = 2,3 - 2,5 V) [14].
|
NO3- + SO4●- → SO42- + NO3● |
(6) |
|
NO3- + HO● → HO- + NO3● |
(7) |
Kết quả Hình 2c cho thấy, ở nồng độ 5 mM, 15 mM thì sau 5 phút hiệu quả xử lý RhB khi có mặt các anion SO42- đạt hiệu quả xử lý từ 97,3 - 86,6%. Ở nồng độ 5 mM, anion SO42- không gây ảnh hưởng nhiều đến quá trình hoạt hóa PMS và xử lý Rhodamine B. Sự ức chế SO42- ở nồng độ 15 mM có thể là do sự hấp phụ trên bề mặt chất xúc tác, làm giảm quá trình hoạt hóa PMS. Trong khi đó, quá trình dập tắt gốc sunfat xảy ra để tạo thành S2O82- (Eo = 2,05 V) (phản ứng 8), có cấu trúc đối xứng và là chất ô xy hóa yếu hơn gốc sunfat [15, 16].
SO42- + SO4●- → S2O82- + e- (8)
3.2. Ảnh hưởng các anion HCO3-, CO32- và HPO42-
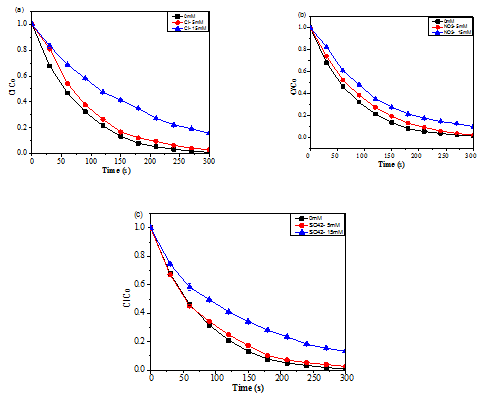
Tương tự như Cl-, NO3- và SO42-, chúng tôi tiến hành nghiên cứu sự ảnh hưởng của các anion HCO3-, CO32- và HPO42- ở nồng độ 5 mM, 15 mM đến hiệu quả loại bỏ RhB quá trình hoạt hóa PMS bởi xúc tác CoFe-LDH. Quá trình khảo sát trong điều kiện thí nghiệm [RhB] = 70 mg/L; [Xúc tác] = 50 mg/L; [PMS] = 500 mg/L; [Anion] = 0 - 15 mM, nhiệt độ = 30oC. Kết quả của nghiên cứu được biểu thị trên Hình 3.
Hình 3. Ảnh hưởng của các anion HCO3-, CO32- đến sự phân hủy RhB trong hệ CoFe-LDH/PMS
Kết quả Hình 3a - 3b cho thấy, ở nồng độ 5 mM, 15 mM thì các anion HCO3-, CO32- gần như ức chế hoàn toàn quá trình hoạt hóa PMS và xử lý Rhodamine B. Điều này có thể được giải thích như sau: HCO3-, CO32- có thể phản ứng với các gốc HO●, SO4●- để tạo ra các gốc yếu hơn như CO3●- (Eo = 1,78 V), HCO3● (Eo = 1,65 V) (phản ứng 9 - 10) [4, 17]. Mặt khác, HCO3- và CO32- có thể phản ứng trực tiếp với PMS để tạo ra peroxymonocarbonate (HCO4-, Eo = 1,8 V), chất này không ổn định, bị phân hủy thành hydrogen peroxide và HCO3- (phản ứng 11 - 12) [18]. Ngoài ra, ion HCO3- và CO32- có khả năng hấp phụ lên bề mặt CoFe-LDH làm giảm khả năng hoạt hóa PMS [19, 20]. Ngoài ra, sự có mặt của CO32- cũng làm tăng pH của dung dịch thành môi trường kiềm mạnh (tức là pH ≈11), ức chế mạnh sự hoạt hóa PMS, dẫn đến giảm sự phân hủy RhB.
|
2 HCO3- + SO4●- + HO● → HCO3● + CO3●- + SO42- + H2O |
(9) |
|
2 CO32- + SO4●- + HO● → CO3●- + SO42- + HO- |
(10) |
|
2 HSO5- + HCO3- + CO32- → 2 HCO4- + CO42- + H+ + SO42- |
(11) |
|
HCO4- + CO42- + 2 H2O → 2 H2O2 + HCO3- + CO32- |
(12) |
Với anion HPO42- cũng giảm rất mạnh hiệu quả xử lý Rhodamine B (Hình 3c) khi tăng nồng độ từ 1 mM lên 15 mM (43,6 - 19,1%), giải thích cho sự thay đổi trên là do HPO42- có thể phản ứng với gốc SO4●- và tạo ra gốc tự do photphat ít phản ứng hơn theo phương trình 12 - 13:
|
HPO42- + SO4●- → HPO4●- + SO42- |
(12) |
|
HPO42- + HO● → HPO4●- + OH- |
(13) |
Ngoài ra, HPO42- có thể tạo thành phức chất với coban (II) và Fe (III) là tâm xúc tác CoFe-LDH, qua đó làm chậm khả năng hoạt hóa PMS và giảm hiệu quả xử lý RhB [17, 21].
3.3. Ảnh hưởng của nền mẫu nước thực
Để đánh giá hiệu quả xử lý Rhodamine B khi có mặt của các thành phần nền trong nước thải sinh hoạt, nước sông, nước hồ, nước thải công nghiệp bởi hệ CoFe-LDH/PMS/RhB, chúng tôi tiến hành so sánh quá trình xử lý RhB trong nước cất hai lần, nước thải sinh hoạt, nước Hồ Tây, sông Tô Lịch và nước thải công nghiệp sau xử lý (Hình 1) trong cùng điều kiện phản ứng: [RhB] = 70 mg/L, [PMS] = 500 mg/L, [Xúc tác] = 50 mg/L, pH = 7,0, T = 30oC.
Tiến hành lấy mẫu nước và phân tích thành phần các anion Cl-, SO42-, NO3-, HCO3-, CO32- có trong mẫu nước (mục 2.2), kết quả như Bảng 1.
Bảng 1: Kết quả phân tích thành phần một số mẫu nước mặt và nước thải
|
TT |
Chỉ tiêu |
Đơn vị |
Phương pháp phân tích |
S.TL |
NTSH |
NHT |
NTSXL |
QCVN 08:2015 (Column A2) |
QCVN 40:2011 (colum A) |
|
1 |
CO32- |
mg/l |
SMEWW 2320B-2012 |
KPH |
KPH |
KPH |
KPH |
- |
- |
|
2 |
HCO3- |
mg/l |
SMEWW 2320B-2012 |
396,500 |
155,550 |
122,000 |
30,500 |
- |
- |
|
3 |
SO42- |
mg/l |
SMEWW 4500- SO42-E:2017 |
59,852 |
43,858 |
35,732 |
202,38 |
- |
- |
|
4 |
Cl- |
mg/l |
TCVN 6194 :1996 |
74,806 |
10,636 |
34,035 |
136,849 |
350 |
500 |
|
5 |
NO3- |
mg/l |
TCVN 6180:1996 |
0,117 |
0,278 |
0,319 |
<0,01 |
5 |
- |
|
6 |
NH4+ |
mg/l |
TCVN 6179-1:1996 |
39,36 |
2,08 |
2,8 |
2,47 |
0,3 |
5 |
|
7 |
COD |
mg/l |
SMEWW 5220C:2017 |
57,6 |
25,6 |
32 |
128 |
15 |
75 |
|
8 |
pH |
- |
TCVN 6429:2011 |
7,55 |
8 |
7,4 |
6,8 |
6,5-8,5 |
6,0-9,0 |
|
9 |
TSS |
mg/l |
TCVN 6625:2000 |
146 |
62 |
36 |
10 |
30 |
50 |
Từ kết quả Bảng 1 cho thấy, thông số NH4+ và COD của các mẫu nước đều vượt quá tiêu chuẩn cho phép của QCVN 08:2015 (Cột A2) đối với nước mặt. Cụ thể, hàm lượng Amoni cao hơn từ 7 - 130 lần mức cho phép; COD cao hơn từ 1,7 - 8,5 lần; TSS cao hơn từ 1,2 - 4,9 lần. Các thông số còn lại đều không được quy định hoặc dưới tiêu chuẩn cho phép.
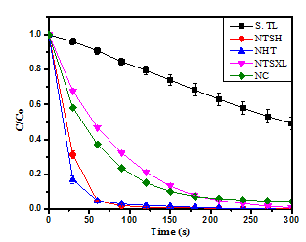
Hình 4. Phân hủy RhB trong một số nguồn nước bởi hệ CoFe-LDH/PMS
Từ Hình 4 cho thấy, đối với nước cất hai lần sau 5 phút đã phân hủy được 99,045 % RhB. Trừ nước sông Tô Lịch, sự có mặt của các thành phần nền môi trường đều làm phân hủy hoàn toàn Rhodamin B. Đối với nước Hồ Tây và nước thải sinh hoạt làm tăng cường sự phân hủy Rhodamin B. Cụ thể, nước Hồ Tây và nước thải sinh hoạt chỉ sau một phút đã loại bỏ tương ứng 95,5% và 95% RhB, sau 3 phút đã loại bỏ hoàn toàn RhB. Sở dĩ khả năng loại bỏ tăng là do hàm lượng các anion < 5 mM, mặt khác, TSS nhỏ, ít ảnh hưởng đến điện tích bề mặt chất xúc tác, qua đó ít ảnh hưởng đến hoạt hóa của hệ CoFe-LDH/PMS. Với nước thải công nghiệp sau xử lý thì hiệu quả loại bỏ RhB là 95,4% sau 5 phút. Với nước thải sông Tô lịch thì hiệu quả thấp hơn, sau 5 phút loại bỏ RhB được 50,94%. Hiệu quả phân hủy Rhodamin B thấp khi có mặt nền môi trường sông Tô Lịch có thể do nồng độ NH4+ và hàm lượng các chất hữu cơ (COD), TSS cao, đã hấp phụ lên bề mặt xúc tác, từ đó gây ức chế, cản trở quá trình tiếp xúc, hoạt hóa của xúc tác với PMS, giảm sự hình thành các gốc tự do, ngoài ra, hàm lượng HCO3- 396,5 mg/l cũng gây ảnh hưởng đến khả năng loại bỏ RhB đối với hệ CoFe-LDH/PMS phù hợp với nghiên cứu ảnh hưởng của HCO3- ở mục 3.2.
4. Kết luận
Trong nghiên cứu này, khả năng phân hủy Rhodamin B bởi hệ CoFe-LDH/PMS khi có mặt của anion (NO3-, Cl-, SO42-, HPO42-, HCO3- và CO32-, nồng độ 5 mM, 15 mM) và nền mẫu môi trường nước thực đã được khảo sát. Kết quả cho thấy, đối với nước cất hai lần, sau 5 phút phân hủy được 99,045% RhB. Các anion NO3-, Cl-, SO42- gây ức chế nhẹ, HPO42- ức chế mạnh, trong khi HCO3- và CO32- ức chế hoàn toàn quá trình phân hủy của Rhodamin B. Sự phân hủy Rhodamin B được tăng cường khi sự hiện diện của nền mẫu nước Hồ Tây và nước thải sinh hoạt. Tuy nhiên, sự có mặt của nền mẫu nước sông Tô Lịch gây ức chế đáng kể tới hiệu quả loại bỏ RhB. Quá trình ô xy hóa nâng cao trên cơ sở hệ CoFe-LDH/PMS có khả năng ứng dụng để xử lý chất ô nhiễm hữu cơ trong các nền mẫu khác nhau.
Lời cảm ơn: Công trình này được ủng hộ bởi đề tài nghiên cứu khoa học hỗ trợ cán bộ trẻ năm 2022 của Viện Công nghệ môi trường “Nghiên cứu ảnh hưởng của các anion đến khả năng hoạt hóa PMS của vật liệu CoFe-LDH để phân hủy rhodamin B trong nước”.
Trần Thị Trang(1)
Nguyễn Trung Dũng(2)
Nguyễn Thị Huyền(1)
Trần Thu Huơng(1
Đào Thị Hường(1)
Nguyễn Trần Điện(1)
Viện Công nghệ môi trường, Viện Hàn lâm Khoa học và Công nghệ Việt Nam
Khoa Hóa - Lý kỹ thuật, Trường Đại học Kỹ thuật Lê Quý Đôn
(Nguồn: Bài đăng trên Tạp chí Môi trường, số Chuyên đề Tiếng việt III/2022)
|
RESEARCH ON THE EFFECT OF ENVIRONMENTAL BACKGROUND ON DECOMPOSING ABILITY OF RHODAMIN B IN WATER BY CoFe-LDH/PMS SYSTEM Tran Thi Trang(1) Nguyen Trung Dung(2) Nguyen Thi Huyen(1) Tran Thu Huong(1) M.Sc.Đao Thi Huong(1) Dr.Nguyen Tran Dien(1) (1) Institute of Environmental Technology, Vietnam Academy of Science and Technology (2) Faculty of Physical and Chemical Engineering, Le Quy Don Technical University Abstract: In this study, we investigated the effect of anions (Cl-, NO3-, SO42-, HCO3-, HPO42-, CO32- at concentrations of 5mM and 15mM) and domestic water sample on the removal efficiency of Rhodamine B using PMS activation by CoFe-LDH catalyst at optimal conditions [RhB] = 70 mg/L; [Catalyst] = 50 mg/L; [PMS] = 500 mg/L; Temperature = 30oC. When using double-distilled water, 99.095% of RhB was decomposed after 5 minutes. The results show that the presence of anions at low concentration (5mM) ware anion influence level as follow: NO3- ≈ Cl- ≈ SO42- < HPO42- < HCO3- ≈ CO32-. When increasing the concentration of anion to 15 mM, the ability òinhibited RhB degradation increased gradually as follows: NO3‑ < SO42- < Cl- < HPO42- < HCO3- ≈ CO32-. The presence of domestic water samples (domestic wastewater, West lake water, treated industrial wastewater) were decomposed completely Rhodamine B. In particular, domestic wastewater and West lake water accelerated the growth rate of Rhodamin B. decomposition and reduced processing time. To Lich river water inhibited Rhodamine B degradation, reaching 50,94% after 5 minutes. Keywords: CoFe-LDH, PMS, Sulfate radical, Rhodamine B, anions, actual water samples. |
Tài liệu tham khảo
1.Dung, N.T., et al., Enhanced degradation of organic dyes by peroxymonosulfate with Fe3O4 - COCO3/rGO hybrid activation: a comprehensive study. Journal of the Taiwan Institute of Chemical Engineers, 2022.133:p.104279.
2.Tan, J., et al., Visible-light-assisted peroxymonosulfate activation by metal-free bifunctional oxygen-doped graphitic carbon nitride for enhanced degradation of imidacloprid: Role of non-photochemical and photocatalytic activation pathway. Journal of hazardous materials, 2022.423:p.127048.
3. Sheng, B., et al., On peroxymonosulfate-based treatment of saline wastewater: when phosphate and chloride co-exist. RSC advances, 2018.8 (25):p.13865-13870.
4. Nie, M., et al., Enhanced removal of organic contaminants in water by the combination of peroxymonosulfate and carbonate. Science of The Total Environment, 2019.647:p.734-743.
5. Xu, L., et al., Catalytic degradation of acid red B in the system of ultrasound/peroxymonosulfate/Fe3O4. Separation and Purification Technology, 2021.276:p.119417.
6. Lê Thanh Sơn, T.T.T., Nguyễn Trần Điện, Nguyễn Trần Dũng, Đặc trưng hóa lý và khả năng phân hủy chất màu của vật liệu hydroxit lớp kép Fe-Co được tổng hợp bằng phương pháp đồng kết tủa. 2020:p.4.
7. Lê Thanh Sơn, T.T.T., Trần Thu Hương, Nguyễn Trần Điện, Nguyễn Trần Dũng, Nghiên cứu một số yếu tố ảnh hưởng đến khả năng hoạt hóa peroxymonosunfat (PMS) của vật liệu Co-Fe/LDH để xử lý xanh methylen trong nước. Tạp chí phân tích hóa, lý và sinh học, 2021. T-26 (số 2, 2021):p.5.
8. Sun, D., et al., Magnetic Fe3O4@CoFe-LDH nanocomposite heterogeneously activated peroxymonosulfate for degradation of azo-dye AO7. RSC Advances, 2021.11(33):p. 20258-20267.
9. Hou, L., et al., Heterogeneous activation of peroxymonosulfate using Mn-Fe layered double hydroxide: Performance and mechanism for organic pollutant degradation. Science of the Total Environment, 2019.663:p.453-464.
10. Chen, G., et al., Degradation of tartrazine by peroxymonosulfate through magnetic Fe2O3/Mn2O3 composites activation. Chinese Chemical Letters, 2020.31(10):p.2730-2736.