

02/12/2025
Tóm tắt
Tiềm năng thương mại hóa của tảo Spirulina trong lưu trữ các-bon thông qua thị trường tín chỉ các-bon toàn cầu được đánh giá là đầy hứa hẹn nhưng vẫn đối mặt với nhiều thách thức triển khai. Vi tảo, bao gồm Spirulina, là giải pháp sinh học hứa hẹn nhờ hiệu suất quang hợp cao (10-50 lần so với cây trồng trên cạn). Đồng thời, sinh khối Spirulina tạo ra nhiều nguồn giá trị gia tăng như thực phẩm, thức ăn chăn nuôi, mỹ phẩm đến nhiên liệu sinh học. Các nghiên cứu tổng quan cho thấy, phương pháp cố định CO₂ bằng Spirulina có lợi thế chi phí thấp so với nhiều công nghệ khác, trong khi tính khả thi kinh tế được củng cố nhờ doanh thu kết hợp từ tín chỉ các-bon và các sản phẩm đồng giá trị. Việc nuôi trồng và ứng dụng Spirulina thể hiện kịch bản “đôi bên cùng có lợi”, vừa góp phần thu giữ và lưu trữ các-bon, vừa thúc đẩy phát triển bền vững. Tuy nhiên, các bằng chứng hiện tại mới dừng lại ở mức thí nghiệm, thí điểm hoặc lý thuyết; trong khi tín chỉ các-bon vẫn chủ yếu được xem như một nguồn thu tiềm năng chứ chưa có sự tham gia thực tiễn ở quy mô thương mại.
Từ khóa: Spirulina, quang hợp và hấp thụ CO2, tín chỉ các-bon, thị trường các-bon, lưu trữ các-bon.
JEL Classifications: Q51, Q52, Q56, Q57.
Trong bối cảnh khủng hoảng khí hậu toàn cầu ngày càng nghiêm trọng, phát thải khí nhà kính, đặc biệt là CO₂, tiếp tục tăng bất chấp các nỗ lực giảm thiểu. Báo cáo Ngân sách Các-bon Toàn cầu 2024 công bố tại COP29 cho thấy lượng phát thải CO₂ đạt mức kỷ lục 41,6 tỷ tấn, chủ yếu từ đốt than, dầu và khí đốt - những nguồn năng lượng then chốt nhưng cũng là nguyên nhân chính gây nóng lên toàn cầu [1]. Các chính sách hiện nay đang tập trung hướng đến công nghệ thu giữ, sử dụng và lưu trữ các-bon (CCUS) - đặc biệt là mô hình năng lượng sinh học kết hợp CCUS (BECCUS - Bioenergy with Carbon Capture, Utilization and Storage) - được xem là hướng tiếp cận chiến lược hướng tới trung hòa các-bon [2].
Trong các giải pháp sinh học, vi tảo, bao gồm Spirulina sp., được xem là “cỗ máy hấp thụ CO₂” tự nhiên hiệu quả nhờ tốc độ quang hợp cao và hàm lượng các-bon lớn trong sinh khối [2, 3]. Về lý thuyết, vi tảo có thể cố định tới khoảng 500 tấn CO₂/ha/năm, tương ứng với khoảng 280 tấn sinh khối khô/ha/năm trong điều kiện tối ưu - cao hơn rất nhiều so với rừng tự nhiên [2, 3]. Spirulina sp. là một chi vi khuẩn lam (Cyanobacteria) quang hợp, đa bào, có cấu trúc dạng sợi xoắn ốc (trichome), đã được thương mại hóa rộng rãi trong ngành thực phẩm chức năng, mỹ phẩm và dược phẩm [4, 5]. Để tạo 1 kg sinh khối Spirulina cần khoảng 1,88 kg CO₂ [6], cao hơn nhiều so với khả năng hấp thụ của cây xanh. Với đặc tính này, việc tích hợp Spirulina sp. vào mô hình BECCUS mở ra tiềm năng lớn cho lưu trữ các-bon sinh học và phát triển kinh tế tuần hoàn. Đây là hướng đi phù hợp cho Việt Nam – một trong những quốc gia chịu ảnh hưởng nặng nề nhất của biến đổi khí hậu – trong quá trình chuyển đổi sang nền kinh tế phát thải thấp và bền vững. Bài viết áp dụng phương pháp phân tích – tổng hợp lý thuyết kết hợp đánh giá có hệ thống tài liệu nhằm xác định cơ sở khoa học cho việc đánh giá tiềm năng lưu trữ các-bon của Spirulina sp. và khả năng tích hợp sinh khối tảo trong hệ thống BECCUS. Tổng quan này hướng đến các mục tiêu sau: (1) Tổng hợp định lượng khả năng cố định và lưu trữ CO₂ của Spirulina sp.; (2) Phân tích khả năng thương mại hóa và tham gia thị trường tín chỉ các-bon của giống tảo này; Chúng tôi tập trung vào các số liệu định lượng hấp thụ CO2 trong các điều kiện khác nhau và phân tích tính khả thi về mặt kinh tế và thị trường để hướng đến thị trường tín chỉ các-bon. Quy trình nghiên cứu được minh họa ở Hình 1.

Hình 1. Quy trình tổng quan tài liệu nghiên cứu
Lịch sử nghiên cứu tảo xoắn cho thấy từ khi được phát hiện năm 1827 đến năm 1989, giới khoa học đã nhiều lần thay đổi quan điểm phân loại giữa hai chi Spirulina và Arthrospira, trước khi chính thức công nhận chúng là hai chi riêng biệt [7]. Spirulina platensis có tốc độ sinh trưởng cao, giàu protein và được ứng dụng trong xử lý môi trường, sản xuất thực phẩm chức năng, dược phẩm và nhiên liệu sinh học [7]. Sự sinh trưởng của Spirulina platensis chịu ảnh hưởng mạnh bởi các yếu tố môi trường như ánh sáng, nhiệt độ, pH, thành phần dinh dưỡng và nồng độ CO₂ [8]. Ánh sáng quyết định hiệu suất quang hợp, sinh khối và thành phần sinh hóa của tế bào; trong đó, cường độ và bước sóng khác nhau ảnh hưởng đến chuyển hóa nội bào, với ánh sáng đỏ cho hiệu suất cao nhất và ánh sáng xanh lam kém hiệu quả nhất [9]. Về môi trường dinh dưỡng, môi trường Zarrouk là nền tảng phổ biến nhất nhưng chi phí cao, do đó nhiều nghiên cứu tập trung cải tiến bằng cách thay thế NaHCO₃ hoặc giảm tỷ lệ dinh dưỡng [10]. Các cải tiến này giúp duy trì mật độ và năng suất sinh khối cao với chi phí thấp hơn. Độ pH cũng là yếu tố giới hạn quan trọng, ảnh hưởng đến khả năng hấp thu dinh dưỡng và cố định CO₂; Spirulina sinh trưởng tối ưu trong khoảng pH 8,5–10,5 [8]. Nhiệt độ thích hợp dao động từ 30–35 °C, vượt ngưỡng này có thể gây ức chế sinh trưởng [11]. Cuối cùng, nồng độ và tốc độ sục khí CO₂ cần được tối ưu hóa để đảm bảo cung cấp đủ các-bon mà không làm giảm pH quá mức [7, 12].
Tảo có khả năng hấp thụ và cố định CO₂ thông qua quá trình quang hợp, trong đó CO₂ và nước được chuyển hóa thành hợp chất hữu cơ dưới tác động của ánh sáng, đồng thời giải phóng oxy [3–5, 13]
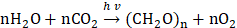
Hiệu suất thu giữ CO₂ của vi tảo trong điều kiện tối ưu có thể đạt 80–99%. Khi tiếp xúc với nồng độ CO₂ cao, vi tảo thể hiện khả năng điều chỉnh sinh lý và tăng cường cơ chế thích nghi nhằm khai thác hiệu quả nguồn các-bon. Việc tăng nồng độ CO₂ trong môi trường nuôi cấy được chứng minh giúp gia tăng đáng kể tốc độ cố định CO₂ và sinh trưởng của tảo [7, 14, 15] . Hiện nay, việc đánh giá khả năng hấp thụ CO₂ của vi tảo chủ yếu dựa trên sự thay đổi sinh khối trong quá trình nuôi cấy, thông qua các công thức tính toán tốc độ cố định CO₂ (FCO₂). Thông thường, FCO₂ được xác định từ năng suất sinh khối (PX) kết hợp với hàm lượng các-bon trong sinh khối (fC) và hệ số chuyển đổi khối lượng (MCO₂/MC ≈ 3,67), phản ánh mối quan hệ giữa lượng các-bon cố định và lượng CO₂ tương ứng [16, 17]. Ngoài ra, tổng lượng CO₂ được hấp thụ trong hệ thống quang sinh học (FA) được tính dựa trên chênh lệch nồng độ sinh khối đầu – cuối, hàm lượng các-bon trong sinh khối và thể tích môi trường nuôi [6]. Một số nghiên cứu còn sử dụng hệ số chuyển đổi khối lượng 1,87–1,88 để ước tính nhanh tốc độ cố định CO₂ từ năng suất sinh khối (mg/L·d). Hiệu suất sử dụng CO₂ (ECO₂) thể hiện tỷ lệ giữa lượng CO₂ được cố định và lượng CO₂ cấp vào, phụ thuộc vào tốc độ cố định, thể tích bể nuôi và lưu lượng cấp khí [16, 18]. Trong các hệ thống nuôi kín, hiệu suất loại bỏ CO₂ được xác định bằng cách so sánh nồng độ CO₂ ở khí đầu vào và đầu ra [6]. Đối với hệ thống kết hợp hấp thụ và chuyển đổi vi tảo (CAMC), hiệu suất chuyển đổi các-bon (EC) được đánh giá dựa trên lượng bicác-bonate tiêu thụ, hàm lượng các-bon trong tảo Spirulina platensis và khối lượng sinh khối khô, với tỉ lệ quy đổi các-bon trong NaHCO₃ là 12/84 [10].
Sự đa dạng trong ứng dụng sinh khối - từ thực phẩm, năng lượng, nông nghiệp, xử lý nước thải đến dược phẩm – đã mở rộng tiềm năng khai thác khả năng cố định các-bon của Spirulina [19, 20]. Nhiều nghiên cứu đã định lượng khả năng hấp thụ CO₂ của Spirulina trong các hệ nuôi khác nhau như ao hở, ao nước chảy (raceway ponds), hệ quang sinh học kín (PBR) và mô hình bán kín. Ao hở có chi phí thấp nhưng khó kiểm soát môi trường và dễ nhiễm tạp [6, 21–23]. Trong khi ao nước chảy - chiếm khoảng 90% sản lượng tảo thương mại toàn cầu - giúp cải thiện phân bố dinh dưỡng và phù hợp sản xuất quy mô lớn, đặc biệt khi kết hợp nhà kính [22, 24]. Ngược lại, PBR kín cho phép kiểm soát hoàn toàn các điều kiện nuôi, tạo sinh khối tinh khiết với năng suất cao nhưng chi phí lớn và khó mở rộng [25, 26]. Mô hình bán kín là giải pháp trung gian, giảm thất thoát nước và nhiễm tạp, song hiệu suất vẫn thấp hơn PBR [6, 16, 27].
Chúng tôi đã xác định nhiều nghiên cứu báo cáo dữ liệu định lượng về khả năng cố định CO₂ của vi tảo (đặc biệt là Spirulina) trong các điều kiện khác nhau (Bảng 1). Các kết quả thực nghiệm cho thấy Spirulina có khả năng cố định khoảng 0,1-0,4 g CO₂/L·ngày khi được bổ sung CO₂, tương ứng với tỷ lệ trung bình 1,8 kg CO₂/kg sinh khối khô. Khả năng cố định CO₂ của Spirulina thay đổi theo nguồn các-bon, nồng độ CO₂, ánh sáng, pH, nhiệt độ và dinh dưỡng [5, 22]. Ở quy mô lớn, các tốc độ trên tương ứng với hàng chục đến hàng trăm tấn CO₂ được cố định mỗi năm trên mỗi hecta. Nghiên cứu của Duarte và cộng sự ước tính khoảng 15 t CO₂/ha·năm, trong khi Zhang báo cáo giá trị tối đa ~124 t CO₂/ha·năm trong điều kiện PBR lý tưởng. Camara và cộng sự ghi nhận tới 0,90 g/L·ngày, tương ứng hàng trăm t CO₂/ha·năm [3, 28]. Nhìn chung, trong điều kiện tối ưu, Spirulina có thể cô lập khoảng 10² t CO₂/ha·năm, phù hợp với các giá trị cực đại lý thuyết trong các tổng quan nghiên cứu.
Bảng 1. Một số nghiên cứu về khả năng cố định CO₂ của Spirulina
|
Tác giả (Năm) |
Quốc gia |
Phương pháp và điều kiện nuôi |
CO₂ cố định* |
|
Hsiao-Wei Chen và cộng sự, (2012) [29] |
Malaysia |
PBR 30 m³, Diện tích ~100 m³ đất; khí CO₂ từ khói thải; điều kiện ngoài trời |
~2.234 kg CO₂/năm; 74 tCO₂/ha·năm |
|
Chen và cộng sự (2013) [30] |
Đài Loan |
PBR kiểu bình nhỏ; Ánh sáng từ 100 → 700 µmol/m²s; tối ưu N ở 0,045 M |
≈ 1,58 g CO₂/L·ngày |
|
Duarte và cộng sự (2017) [28] |
Brazil |
PBR bench-scale; 10% CO₂ từ khí thải; môi trường Zarrouk |
0,135 g/L·ngày |
|
Cardias và cộng sự (2018) [31] |
Brazil |
PBR 1,8 L (ống dọc); 12% v/v CO₂ khí; thêm 1,64 mmol/L diethanolamine + 0,41 mmol/L K₂CO₃ |
~0,174 g CO₂/L·ngày (174,2 mg/L·ngày) |
|
Zhang và cộng sự (2019) [22] |
Trung Quốc |
Cột PBR và ao bán liên tục; 10% CO₂; pH = 9,5; ánh sáng tự nhiên |
0,414 g/L·ngày |
|
Ramirez-Perez và cộng sự (2021) [32] |
Brazil |
PBR bán liên tục, ở các mức mặn khác nhau; CO₂ 2,5% cho kết quả tốt nhất; Nhiệt độ 10-40 °C; ánh sáng từ 60-200 µmol/m²·s; độ mặn thử nghiệm 1-100 g/L NaCl |
Tối đa ~25,1 gCO₂/m³·giờ (≈0.60 g CO₂/L·ngày nếu tính 24h) |
|
Zhang và cộng sự (2022) [10] |
Trung Quốc |
Bình nhỏ; NaHCO₃ 0,3 M; ánh sáng: sục = 12:12 h |
0,230 g C/L·ngày |
|
Pengcheng Li và cộng sự (2023) [33] |
Trung Quốc |
Nuôi CAMC với các nhóm có acetate (0,5 g/L) so với đối chứng; Điều kiện ánh sáng & dinh dưỡng tiêu chuẩn; |
Hiệu suất cố định các-bon tăng ~60,47%, 63,06% và 59,77% so với đối chứng khi dùng 0.5 g/L acetate |
|
Ngoenkhamkhong, N. và cộng sự (2022) [34] |
Thái Lan |
PBR 5 L, CO₂ (99%) liên tục khí đầu, chiếu sáng 4 000 lux; 20 ngày; Sparging 0,05 vvm; |
Vi tảo Spirulina sp. có hiệu suất cố định CO₂ giảm thấp hơn Chlorella ~4.073 mg/L·ngày |
|
Chunzhuk và cộng sự (2023) [35] |
Nga |
PBR, 90 L; Trung bình CO₂ ban đầu: 1, 5, 9 vol-%, nước tinh, môi trường Zarrouk; ánh sáng & pH điều chỉnh |
Tốc độ tăng sinh khối: ~79,4 mg/L·ngày ở 1%; ~76,3 mg/L·ngày ở 5% CO₂ |
|
Dębowski và cộng sự (2024) [36] |
Ba Lan |
Thí nghiệm PBR/điều kiện phòng thí nghiệm, đo tốc độ tăng sinh khối (volatile solids, VS). |
0,376 g CO₂/L.ngày |
|
Jung và cộng sự (2024) [37] |
Đức |
Thí nghiệm PBR, pha tuyến tính, NaHCO₃/CO₂; 30 °C, pH 9,5 ± 0,2, ánh sáng 120 µmol/m²s, PBR 5 L. |
0,35 g CO₂/L.ngày |
|
Kumar và cộng sự (2025) [38] |
Trung Quốc |
PBR dạng cột, 2L; Nhiệt độ 30 ± 1 °C, ánh sáng 3000 lx, pH 9,5; CO₂ đầu vào 15 % (v/v), sục khí 0,03 L CO₂ min⁻¹
|
0,312 g CO₂/L.ngày |
|
Wang và cộng sự (2019) [39] |
Trung Quốc |
Hệ thống thí điểm 10m2; gồm 4 mô-đun, 12 tấm sợi tổng hợp/mô-dun, pH = 9–9,5; CO₂ 99,9% sục 1 L/phút; điều kiện nhà kính; chiếu sáng tự nhiên; 45 ngày |
Tỷ lệ cố định 75% ~ Năng suất sinh khối trung bình = 38,3 g/m²ngày → tương đương ~140 t CO₂/ha.năm |
|
Zhu và cộng sự (2020) [22] |
Trung Quốc (Mông Cổ) |
Ao nước chảy 605 m2; CO₂ tinh khiết từ khí thải (99,99%), pH 9,5, DIC = 0.1 mol/L, phosphate 200 mg/L, nhiệt độ 28–37 °C, ánh sáng tự nhiên. |
0,414 g CO₂/L·ngày (LAMB220); tương đương ~180 t CO₂/ha·năm (ước tính với độ sâu 0,3 m) |
*Giá trị CO₂ cố định được trích từ các nghiên cứu đã dẫn, đề cập đến tốc độ hấp thụ được báo cáo
Khả năng cố định các-bon của vi tảo, đặc biệt là Spirulina, đã được chứng minh rõ ràng qua nhiều nghiên cứu. Tuy nhiên, việc thương mại hóa hoạt động này vẫn đối mặt với các rào cản lớn cả về kỹ thuật lẫn kinh tế. Các hệ thống nuôi tảo được thiết kế tối ưu có thể đạt hiệu suất hấp thụ CO₂ gần với giá trị lý thuyết 1,8 kgCO₂/kg sinh khối khô [22]. Dựa trên dữ liệu tổng hợp (Bảng 1), tốc độ cố định CO₂ 0,135-0,414 g/L·ngày tương ứng với khoảng 15-120 tCO₂/ha·năm (với độ sâu lớp nuôi cấy khoảng 0,3 m). Nếu quy đổi theo tỉ lệ 1 tCO₂ = 1 tín chỉ các-bon, mức này tương ứng 15-120 tín chỉ/ha·năm. Với giá trên thị trường tự nguyện hiện nay (khoảng 5-15 USD/tCO₂), doanh thu tiềm năng chỉ ở mức 75-1.800 USD/ha·năm - con số này tương đối khiêm tốn so với chi phí vận hành và đầu tư.
Các phân tích kỹ thuật - kinh tế cho thấy chi phí sản xuất sinh khối Spirulina phụ thuộc nhiều vào công nghệ: hệ ao hở có chi phí khoảng 5–12 USD/kg sinh khối, trong khi các hệ PBR (photobioreactor) và các BPR (bioreactor) có chi phí cao hơn (10-25 USD/kg) [5]. Quá trình sấy khô sinh khối còn làm tăng chi phí thêm khoảng 15-30 USD/kg [5]. Một số báo cáo, ví dụ ở Trung Quốc, ghi nhận các cơ sở thí điểm có khả năng hấp thụ hàng chục nghìn tấn CO₂ mỗi năm thông qua hồ nuôi tảo [3]; Ngay cả khi giả định giá tín chỉ tăng lên 100 USD/tCO₂, việc bù đắp chi phí cho mỗi kg sinh khối vẫn rất nhỏ (xấp xỉ 0,10 USD/kg), cho thấy tín chỉ các-bon hiện khó có thể trở thành nguồn thu chính nếu không có giảm chi phí mạnh hoặc tăng giá các-bon toàn cầu đáng kể. Do đó, xét về mặt kinh tế và cấu trúc thị trường hiện nay, doanh thu từ tín chỉ các-bon chưa đủ để bù đắp chi phí sản xuất Spirulina.
Ngược lại, Spirulina có thể đem lại giá trị kinh tế đáng kể từ các kênh khác. Sinh khối Spirulina là sản phẩm có giá trị cao trong thực phẩm chức năng, phụ gia dinh dưỡng, mỹ phẩm và một số ứng dụng công nghiệp; theo ước tính của IEA, sản lượng toàn cầu khoảng 10.000 tấn/năm (khối lượng khô), trong đó Trung Quốc chiếm khoảng một nửa [5]. Với giá bán sản phẩm dinh dưỡng thường ở mức 30-50 USD/kg, doanh thu từ sản phẩm thương mại có thể phủ lấp chi phí thu hoạch và chế biến, cho phép tín chỉ các-bon đóng vai trò bổ sung hoặc đồng tài trợ cho các dự án thu giữ CO₂. Hơn nữa, tích hợp nuôi Spirulina với xử lý nước thải, thu hồi CO₂ từ khí thải công nghiệp, hoặc đồng sản xuất nhiên liệu sinh học/nhựa sinh học có thể cải thiện hiệu quả kinh tế và giảm cường độ phát thải trên đơn vị sản phẩm.
Khả năng lưu trữ các-bon lâu dài và tiêu chuẩn tín chỉ loại bỏ các-bon
Hầu hết lượng các-bon mà Spirulina hấp thụ chỉ được lưu giữ tạm thời trong sinh khối ngắn hạn — sinh khối này nhanh chóng bị phân hủy hoặc tiêu thụ và do đó CO₂ có thể được giải phóng trở lại khí quyển. Vì vậy, quy trình cố định CO₂ trong các hệ PBR thông thường chưa đáp ứng tiêu chí để được công nhận là tín chỉ loại bỏ các-bon (removal credits). Để đủ điều kiện nhận tín chỉ loại bỏ, các dự án cần chứng minh khả năng lưu trữ các-bon lâu dài và ổn định, tức là lượng các-bon cố định phải được giữ lại khỏi chu trình khí quyển trong thời gian đáng kể (thường được định nghĩa bằng hàng chục đến hàng trăm năm) thông qua các phương thức xử lý và lưu trữ phù hợp. Nhiều giải pháp đã được đề xuất và thí điểm nhằm tăng tính bền vững của lưu trữ các-bon từ sinh khối tảo, gồm:
Xử lý Spirulina khô bằng nhiệt phân hoặc các-bon hóa thủy nhiệt (HTC) để chuyển sinh khối thành biochar với hàm lượng các-bon ổn định cao (~60-70%) và thời hạn lưu trữ >100 năm. Biochar từ tảo đã được thừa nhận trong một số phương pháp luận như Puro.earth Biochar Methodology (2024) [40] và Verra VM0044 [41].
Lưu trữ đại dương (marine CDR) thông qua thử nghiệm chôn sinh khối tảo ở độ sâu lớn (>1.000 m) - một số doanh nghiệp (ví dụ Running Tide, Seafields) đang thử nghiệm hướng này, và IEA (2023, CDR Tracking Report) coi đây là khả năng trong danh mục “ocean storage” [42]
Sinh khối tảo biển có thể áp dụng theo các phương thức lưu trữ các-bon tầng sâu (deep-ocean sequestration) đã được tiêu chuẩn hóa [43, 44].
Cơ hội thương mại hiện tập trung ở các ngách chiến lược, đặc biệt là khi Spirulina được sản xuất kết hợp với xử lý nước thải hoặc tiếp nhận CO₂ từ nguồn phát thải công nghiệp - những mô hình này có thể giảm chi phí nguyên liệu đầu vào và đồng thời cung cấp giá trị môi trường bổ sung. Vi tảo có thể giúp doanh nghiệp đạt các mục tiêu phát triển bền vững (SDGs) nếu được thiết kế và chứng minh đúng theo tiêu chí vòng đời các-bon thấp [5].
Tuy nhiên, để tham gia thị trường tín chỉ các-bon (đặc biệt là tín chỉ loại bỏ), dự án cần đáp ứng các tiêu chuẩn chất lượng ngày càng nghiêm ngặt. Thị trường quốc tế đang nghiêng về các yêu cầu theo Nguyên tắc các-bon cốt lõi (Core Các-bon Principles - CCPs) của ICVCM, bao gồm: tính bổ sung (additionality), không trùng lặp (no double counting), tính lâu dài (permanence) và MRV (Đo lường, báo cáo và thẩm định/Xác minh - Measurement, Reporting, and Verification) đáng tin cậy [45]. Vì vậy, việc chỉ ước tính lượng CO₂ hấp thụ (tCO₂ hấp thụ) là chưa đủ; dự án phải chứng tỏ rằng cơ chế lưu trữ các-bon là bền vững, có hiệu quả vượt trội so với kịch bản thông thường (BAU) và được thẩm tra độc lập để có giá trị trên thị trường quốc tế [45, 46].
Việc xác định lượng CO₂ loại bỏ ròng (net CO₂ removal) đòi hỏi đánh giá vòng đời (LCA) đầy đủ, vì các công đoạn như chiếu sáng, khuấy trộn, sấy khô và vận chuyển có thể phát thải đáng kể đủ để làm giảm hoặc triệt tiêu lợi ích giảm phát thải nếu nguồn năng lượng không phải là tái tạo. Các tài liệu hướng dẫn quốc tế (ví dụ IEA và các phương pháp luận CDR) đều nhấn mạnh yêu cầu báo cáo phát thải ròng minh bạch, dựa trên toàn bộ chuỗi giá trị và được xác minh độc lập [47, 48]. Các phương pháp luận hiện hành (như Puro.earth MCFS hay các tiêu chuẩn Verra cho tảo biển) ưu tiên các hoạt động lưu trữ các-bon dài hạn (trầm tích, tầng biển sâu, biochar, vật liệu bền) và yêu cầu MRV chặt chẽ [43, 49]. Hay nói cách khác, nếu Spirulina muốn được cấp tín chỉ loại bỏ các-bon, các dự án cần thiết kế chuỗi xử lý và lưu trữ các-bon lâu dài tuân thủ các quy tắc trên, đồng thời được thẩm tra bởi bên thứ ba độc lập.
Khoảng trống nghiên cứu hiện nay cũng đáng lưu ý như: Thiếu các đánh giá kinh tế chi tiết của dự án thu giữ CO₂ ở quy mô thương mại kèm dữ liệu thực nghiệm. Tài liệu công bố còn thiếu thống nhất về đơn vị (g CO₂/g sinh khối, t/ha·năm…), khiến việc so sánh kết quả trở nên khó khăn. Hơn nữa, cần có định lượng rõ ràng về chi phí và cường độ các-bon của các hệ thống khác nhau (ao hở so với PBR, hệ mở so với hệ kín). Đặc biệt, các tiêu chuẩn định lượng tín chỉ các-bon - tức số tín chỉ tương ứng với mỗi tấn sinh khối tảo hoặc mỗi tấn CO₂ cố định - vẫn chưa được phát triển. Yêu cầu phát triển các dự án trình diễn (demonstration projects) tích hợp MRV, LCA và phân tích chi phí - lợi ích để cung cấp bằng chứng thực tế về hiệu quả và tính kinh tế đang còn thiếu.
Do đó, các nghiên cứu tiếp theo nên ưu tiên:
Triển khai dự án thí điểm quy mô lớn có bộ MRV hoàn chỉnh và dữ liệu công khai về chi phí - hiệu suất.
Chuẩn hóa đơn vị đo lường và phương pháp báo cáo để tăng tính so sánh giữa các nghiên cứu.
Đánh giá toàn diện LCA kết hợp phân tích kinh tế - kỹ thuật nhằm xác định điều kiện kinh tế khả thi.
Khảo sát các phương án lưu trữ lâu dài (biochar, lưu trữ đại dương, vật liệu bền) và kiểm chứng tính an toàn, độ bền của các phương án này về mặt môi trường và xã hội.
Tóm lại, Spirulina có tiềm năng quan trọng trong việc cố định các-bon, nhưng giá trị thị trường trực tiếp từ tín chỉ các-bon ở thời điểm hiện tại là hạn chế. Việc thương mại hóa thu giữ các-bon từ Spirulina chỉ trở nên khả thi khi: (i) chi phí sản xuất giảm đáng kể hoặc giá các-bon tăng cao; (ii) có những cơ chế lưu trữ các-bon dài hạn và được công nhận; và (iii) các dự án đáp ứng yêu cầu MRV và tiêu chuẩn chất lượng tín chỉ các-bon quốc tế. Trong ngắn hạn, chiến lược hợp lý là tận dụng giá trị thương phẩm cao của sinh khối (sản phẩm dinh dưỡng, mỹ phẩm) kết hợp các mô hình tích hợp (xử lý nước thải, thu hồi CO₂, đồng sản phẩm) để giảm chi phí và đồng thời thử nghiệm các phương thức lưu trữ bền vững nhằm tạo cơ sở cho việc phát triển tín chỉ loại bỏ trong tương lai.
Các loài tảo siêu nhỏ, bao gồm Spirulina, đã được chứng minh có khả năng cố định CO₂ đáng kể trong điều kiện nuôi cấy được kiểm soát, với hiệu suất lý thuyết có thể đạt tới khoảng 500 tCO₂/ha·năm. Tuy nhiên, việc triển khai ở quy mô công nghiệp vẫn gặp nhiều thách thức về kỹ thuật, kinh tế và vận hành. Ngành sản xuất Spirulina thương mại hiện đã phát triển vững chắc trong lĩnh vực thực phẩm và thực phẩm bổ sung, cho thấy tiềm năng tích hợp thêm dịch vụ thu giữ các-bon trong tương lai. Dù các dự án vi tảo có thể đóng góp vào thị trường tín chỉ các-bon, chúng hiện mới chỉ chiếm vị trí bổ trợ trong chuỗi giá trị sinh học tích hợp. Cho đến nay, chưa có chương trình tín chỉ các-bon quy mô lớn nào dành riêng cho Spirulina được triển khai; công nghệ này vẫn ở giai đoạn thí điểm và đánh giá khả thi. Nhìn chung, dù tiềm năng sinh học của vi tảo là rất lớn, việc thương mại hóa tín chỉ các-bon từ nguồn này vẫn cần sự hoàn thiện về công nghệ, tiêu chuẩn đo lường và khung chính sách hỗ trợ rõ ràng hơn.Top of Form
Nguyễn Thị Thanh Trúc1*, Phan Vũ Đăng Khoa1, Nguyễn Thị Lan Bình1
1Viện Khoa học Công nghệ và Quản lý Môi trường, Trường Đại học Công nghiệp Thành phố Hồ Chí Minh
(Nguồn: Bài đăng trên Tạp chí Môi trường số Chuyên đề Khoa học - Công nghệ IV/2025)
1. Global Carbon Budget | GCB 2024. https://globalcarbonbudget.org/gcb-2024/. Accessed 11 Apr 2025.
2. Li G, Yao J (2024) A Review of Algae-Based Carbon Capture, Utilization, and Storage (Algae-Based CCUS). Gases 4:468-503.
3. Tripathi S, Choudhary S, Meena A, Poluri KM (2023) Carbon capture, storage, and usage with microalgae: a review. Environ Chem Lett 21:2085-2128. https://doi.org/10.1007/S10311-023-01609-Y/FIGURES/3.
4. Vieira M V., Pastrana LM, Fuciños P (2020) Microalgae Encapsulation Systems for Food, Pharmaceutical and Cosmetics Applications. Mar Drugs 18.
5. Musa MN, Jirgi GM, Zango ZU, et al (2025) A review on techno-economic assessment of Spirulina for sustainable nutraceutical, medicinal, environmental, and bioenergy applications. Bioresour Bioprocess 12:1-39. https://doi.org/10.1186/S40643-025-00888-3/TABLES/4.
6. Alami AH, Alasad S, Ali M, Alshamsi M (2021) Investigating algae for CO2 capture and accumulation and simultaneous production of biomass for biodiesel production. Science of the Total Environment 759:. https://doi.org/10.1016/j.scitotenv.2020.143529.
7. Sánchez M, Bernal-Castillo J, Rozo C, Rodríguez I (2003) Spirulina (Arthrospira): An edible microorganism: A review. Univ Sci (Bogota) 8:7-24.
8. Zhang Xing (2015) Microalgae removal of CO2 from flue gas. IEA Clean Coal Centre.
9. Satthong S, Saego K, Kitrungloadjanaporn P, et al (2019) Modeling the effects of light sources on the growth of algae. Adv Differ Equ 2019:1–6. https://doi.org/10.1186/S13662-019-2112-6/FIGURES/2.
10. Zhang P, Sun Q, Dong Y, Lian S (2023) Effects of different bicarbonate on spirulina in CO2 absorption and microalgae conversion hybrid system. Front Bioeng Biotechnol 10:. https://doi.org/10.3389/fbioe.2022.1119111.
11. Singh SP, Singh P (2015) Effect of temperature and light on the growth of algae species: A review. Renewable and Sustainable Energy Reviews 50:431-444. https://doi.org/10.1016/J.RSER.2015.05.024.
12. Ismaiel MMS, El-Ayouty YM, Piercey-Normore M (2016) Role of pH on antioxidants production by Spirulina (Arthrospira) platensis. Brazilian Journal of Microbiology 47:298--304. https://doi.org/10.1016/j.bjm.2016.01.003.
13. Michael A, Kyewalyanga MS, Lugomela CV (2019) Biomass and nutritive value of Spirulina (Arthrospira fusiformis) cultivated in a cost-effective medium. Ann Microbiol 69:1387–1395. https://doi.org/10.1007/S13213-019-01520-4.
14. Ughetti A, Roncaglia F, Anderlini B, et al (2023) Integrated Carbonate-Based CO2 Capture-Biofixation through Cyanobacteria. Applied Sciences (Switzerland) 13:10779. https://doi.org/10.3390/APP131910779/S1.
15. Parthiban MS, A. M (2022) Reducing the Carbon Footprint by Cultivating and Consuming Spirulina: A Mini-review. International Journal of Environment and Climate Change 3069–3076. https://doi.org/10.9734/IJECC/2022/V12I111352
16. Mai Thị Huyền Thương, Trần Đăng Thuần, Lại Thị Ngọc Bính, et al (2020) Nghiên cứu phát triển sinh khối vi tảo Spirulina Sp. trong môi trường nước mưa và nước biển kết hợp xử lý CO2. Tạp chí Khoa học và Công nghệ 4.
17. Setiawan Y, Asthary PB, Saepulloh (2019) CO2 flue gas capture for cultivation of Spirulina platensis in paper mill effluent medium. In: AIP Conference Proceedings. American Institute of Physics Inc.
18. Choi W, Kim G, Lee K (2012) Influence of the CO2 absorbent monoethanolamine on growth and carbon fixation by the green alga Scenedesmus sp. Bioresour Technol 120:295–299. https://doi.org/10.1016/J.BIORTECH.2012.06.010
19. Nege AS, Masithah ED, Khotib J (2020) Trends in the uses of spirulina microalga: A mini-review. Jurnal Ilmiah Perikanan dan Kelautan 12:149–166. https://doi.org/10.20473/jipk.v12i1.17506.
20. Abreu AP, Martins R, Nunes J (2023) Emerging Applications of Chlorella sp. and Spirulina (Arthrospira) sp. Bioengineering 2023, Vol 10, Page 955 10:955. https://doi.org/10.3390/BIOENGINEERING10080955.
21. Lê Hoàng Việt, Kim Lavane, Nguyễn Võ Châu Ngân (2023) Nghiên cứu nuôi sinh khối tảo Spirulina Sp. kết hợp xử lý nước thải sinh hoạt. Can Tho University Journal of Science 59:134–144. https://doi.org/10.22144/ctu.jvn.2023.115.
22. Zhu B, Shen H, Li Y, et al (2020) Large-Scale Cultivation of Spirulina for Biological CO2 Mitigation in Open Raceway Ponds Using Purified CO2 From a Coal Chemical Flue Gas. Front Bioeng Biotechnol 7:441. https://doi.org/10.3389/FBIOE.2019.00441.
23. AlFadhly NKZ, Alhelfi N, Altemimi AB, et al (2022) Tendencies Affecting the Growth and Cultivation of Genus Spirulina: An Investigative Review on Current Trends. Plants 2022, Vol 11, Page 3063 11:3063. https://doi.org/10.3390/PLANTS11223063.
24. Ren S, Shao C, Zhu F, et al (2025) Optimization and synergistic enhancement of microalgae productivity in laboratory raceway ponds via co-regulation of automated light-supplemented mixers and electric field system. Biotechnology for Biofuels and Bioproducts 18:1–16. https://doi.org/10.1186/S13068-025-02658-X/FIGURES/6.
25. Abdur Razzak S, Bahar K, Islam KMO, et al (2024) Microalgae cultivation in photobioreactors: sustainable solutions for a greener future. Green Chemical Engineering 5:418-439. https://doi.org/10.1016/J.GCE.2023.10.004.
26. Sarker NK, Kaparaju P (2023) A Critical Review on the Status and Progress of Microalgae Cultivation in Outdoor Photobioreactors Conducted over 35 Years (1986-2021). Energies (Basel) 16:3105. https://doi.org/10.3390/EN16073105/S1.
27. Novoveská L, Nielsen SL, Eroldoğan OT, et al (2023) Overview and Challenges of Large-Scale Cultivation of Photosynthetic Microalgae and Cyanobacteria. Mar Drugs 21:445. https://doi.org/10.3390/MD21080445.
28. Duarte JH, de Morais EG, Radmann EM, Costa JAV (2017) Biological CO2 mitigation from coal power plant by Chlorella fusca and Spirulina sp. Bioresour Technol 234:472–475. https://doi.org/10.1016/j.biortech.2017.03.066.
29. Chen HW, Yang TS, Chen MJ, et al (2012) Application of power plant flue gas in a photobioreactor to grow Spirulina algae, and a bioactivity analysis of the algal water-soluble polysaccharides. Bioresour Technol 120:256–263. https://doi.org/10.1016/J.BIORTECH.2012.04.106.
30. Chen CY, Kao PC, Tsai CJ, et al (2013) Engineering strategies for simultaneous enhancement of C-phycocyanin production and CO2 fixation with Spirulina platensis. Bioresour Technol 145:307–312. https://doi.org/10.1016/J.BIORTECH.2013.01.054.
31. Cardias BB, Morais MG de, Costa JAV (2018) CO2 conversion by the integration of biological and chemical methods: Spirulina sp. LEB 18 cultivation with diethanolamine and potassium carbonate addition. Bioresour Technol 267:77–83. https://doi.org/10.1016/J.BIORTECH.2018.07.031.
32. Ramirez-Perez JC, Janes H (2021) Impact of salinity on the kinetics of CO2 fixation by Spirulina platensis cultivated in semi-continuous photobioreactors. Eclética Química 46:21–34. https://doi.org/10.26850/1678-4618EQJ.V46.1.2021.P21-34.
33. Li P, Hu Z, Yin Q, Song C (2023) Improving the growth of Spirulina in CO2 absorption and microalgae conversion (CAMC) system through mixotrophic cultivation: Reveal of metabolomics. Science of The Total Environment 858:159920. https://doi.org/10.1016/J.SCITOTENV.2022.159920.
34. Ngoenkhamkhong khanchit, Ngoenkhamkhong N, Seesuriyachan P (2022) CO2 Mitigation by Algae. Recent Science and Technology 14:454–464.
35. Chunzhuk EA, Grigorenko A V., Chernova NI, et al (2023) Direct Study of CO2 Capture Efficiency during Microalgae Arthrospira platensis Cultivation at High CO2 Concentrations. Energies 2023, Vol 16, Page 822 16:822. https://doi.org/10.3390/EN16020822/
36. Dębowski M, Zieliński M, Vdovychenko A, Kazimierowicz J (2024) The Use of the Autotrophic Culture of Arthrospira platensis for CO2 Fixation from Biogas Combustion. Processes 2024, Vol 12, Page 396 12:396. https://doi.org/10.3390/PR12020396.
37. Jung CGH, Nghinaunye T, Waldeck P, et al (2024) Decarbonization of Arthrospira platensis production by using atmospheric CO2 as an exclusive carbon source: proof of principle. JEST 21:4635–4644. https://doi.org/10.1007/S13762-023-05215-X.
38. Kumar S, Kubar AA, Hu X, et al (2025) Enhancement of microalgal CO2 fixation in photobioreactors by means of spiral flow vortices. Biotechnology for Biofuels and Bioproducts 18:47. https://doi.org/10.1186/S13068-025-02650-5.
39. Wang J, Cheng W, Liu W, et al (2019) Field study on attached cultivation of Arthrospira (Spirulina) with carbon dioxide as carbon source. Bioresour Technol 283:270–276. https://doi.org/10.1016/J.BIORTECH.2019.03.099.
40. Puro Standard - Puro.Earth (2025) Biochar Methodology for CO 2 Removal Edition 2025 V1.
41. Verra VM0044 Biochar Utilization in Soil and Non-Soil Applications, v1.2 - Verra. In: https://verra.org/. https://verra.org/methodologies/vm0044-biochar-utilization-in-soil-and-non-soil-applications-v1-2/. Accessed 21 Oct 2025.
42. Zakkour P, Cook G (2024) Measurement, reporting and verification (MRV) and accounting for carbon dioxide removal (CDR) in the context of both projectbased approaches and national greenhouse gas inventories (NGHGI).
43. Puro Standard - Puro.Earth (2025) Microalgae Carbon Fixation and Sinking Microalgae Carbon Fixation and Sinking - Methodology for CO2 Removal.
44. Mustafa Babiker, Göran Berndes (2021) IPCC AR6 WGIII. Chapter 12: Cross sectoral perspectives. In: Gilberto de Martino Jannuzzi, Andy Reisinger (eds) IPCC’s Sixth Assessment Report.
45. The Integrity Council for the Voluntary Carbon Market (2024) Core carbon principles, assessment framework and assessment procedure.
46. Carbon Markets | UNEP - UN Environment Programme. https://www.unep.org/topics/climate-action/climate-finance/carbon-markets?utm_source=chatgpt.com. Accessed 22 Oct 2025.
47. Olsson O, Abdalla N, Bürck S, Fehrenbach H (2022) Carbon accounting across Bio-CCUS supply chains-identifying key issues for science and policy.
48. Hao Cai, Greg Cooney, Michael Shel (2025) Best Practices for Life Cycle Assessment (LCA) of Biomass Carbon Removal and Storage (BiCRS) Technologies. SW.
49. Methodology Framework for Seaweed Carbon Projects - Verra. https://verra.org/methodologies/methodology-framework-for-seaweed-carbon-projects/. Accessed 21 Oct 2025.