

05/08/2020
TÓM TẮT
Tảo Chlorella vulgaris (C.vulgaris) được xem là một trong những giải pháp sinh học mang lại hiệu quả cao trong việc loại bỏ kim loại nặng trong nước thải. Mangan(Mn) là một kim loại nặng phổ biến có thể gây ra vấn đề nghiêm trọng cho sức khỏe con người và hệ sinh thái. Do đó, nghiên cứu này đã được thực hiện để nghiên cứu ảnh hưởng của các yếu tố môi trường khác nhau bao gồm mật độ tế bào ban đầu, nồng độ kim loại nặng ban đầu và pH đối với khả năng loại bỏ Mn của C.vulgaris. Kết quả thí nghiệm cho thấy, hiệu suất xử lý Mn của C. vulgaris đạt cao nhất 80% được ghi nhận từ môi trường có mật độ tế bào ở mật độ 10,5 x 106 tế bào/ml, nồng độ ion Mn ban đầu 35 mg/l và pH = 6.
Từ khóa: Vi tảo, Chlorella vulgaris, Mangan.
Nhận bài: 23/6/2020; Sửa chữa:27/6/2020; Duyệt đăng: 29/6/2020
1. Giới thiệu
Mangan là một loại vi chất rất cần thiết cho cơ thể con người, tác động đến hệ hô hấp, phát triển hệ xương, ngăn chặn các gốc tự do và tác động đến việc hình thành một số loại enzyme quan trọng cho cơ thể. Tuy nhiên, nồng độ Mn cao trong nguồn nước và các thủy vực sẽ gây ra rủi ro cho sức khỏe của cộng đồng. Tổ chức y tế thế giới năm 2004 đã đưa ra khuyến cáo về mức Mn cho phép hàm lượng trong nước uống là không quá 0,2 mg/l. Nghiên cứu của Gerke và cộng sự đã chỉ ra việc hấp thụ một lượng lớn Mn sẽ gây độc cho cơ thể và ảnh hưởng đến sự phát triển tâm lý[1].
Ô nhiễm kim loại Mn chủ yếu xuất phát từ hoạt động khai khác mỏ, luyện kim loại màu, sản xuất thép, vật liệu điện tử. Hàm lượng lớn Mn giải phóng sẽ gây nguy hại cho hệ sinh thái và sức khỏe của con người. Hiện nay, có nhiều phương pháp hóa lý được sử dụng để loại bỏ kim loại ra khỏi môi trường nước, bao gồm điện hóa, trao đổi ion, kết tủa, hấp phụ bề mặt. Các phương phương pháp hóa lý thường có chi phí cao, không hiệu quả và tạo ra sản phẩm phụ gây ô nhiễm thứ cấp. Trong khi đó, các phương pháp sinh học như sử dụng thực vật, vi sinh vật và nấm thường được các nhà khoa học lựa chọn trong việc loại bỏ các ion kim loại vì chi phí thấp, thân thiện với môi trường và không tạo ra ô nhiễm thứ cấp[2].
Xử lý kim loại nặng bằng vi tảođược xem là một trong những giải pháp sinh học mang lại hiệu quả cao trong bảo vệ môi trường nhờ khả năng hấp phụ ion kim loại trên bề mặt của tế bào[3]. Nhiều nghiên cứu trên thế giới kết luận rằng việc sử dụng vi tảo tách kim loại nặng trong nước thải, là biện pháp mang lại hiệu quả kinh tế, làm tăng chất lượng nước thải có thể tái sử dụng[2]. Nghiên cứu khả năng loại bỏ kim loại nặng (Cd, và Zn) được Travieso và cộng sự (1999) tiến hành trên hai chủng Chlorella vulgaris(C.vulgaris) và Scenedesmus acutus cho thấy hiệu quả xử lý lên đến 91%[4].
Hiệu quả xử lý kim loại của các chủng tảo phụ thuộc khá nhiều vào các điều kiện môi trường. Nghiên cứu của Çetinkaya và cộng sự cho thấy có sự khác nhau về hiệu quả xử lý kim loại ở các pH khác nhau [5]. Bên cạnh đó, các yếu tố như mật độ tảo và nồng độ ion kim loại ban đầu có ảnh hưởng rất lớn đến hiệu quả xử lý của một số loài vi tảo [6]. Nghiên cứu của Lau và cộng sự khi tiến hành xử lý nước thải với mật độ tế bào tảo từ 0,5 đến 10x 106tế bào/ml. Kết quả cho thấy, ở mật độ 10 x 106tế bào/ml cho hiệu quả xử lý nước thải tốt nhất[7]. Bên cạnh đó, nghiên cứu của Bishnoi cho thấy ở pH = 6 và nồng độ 40 mg/l thì vi tảo đạt hiệu quả tốt nhất trong xử lý kim loại nặng[8].
Tại Việt Nam, nghiên cứu loại bỏ ion kim loại bằng vi tảo mới được bắt đầu chú ý trong những năm gần đây, với một số nghiên cứu đáng chú ý của tác giả Phạm Duy Thanh và Đào Thanh Sơn. Trong nghiên cứu này sử dụng chủng vi tảo C. vulgaris được phân lập ở ao nuôi tôm của công ty Trường Định, quận Liên Chiểu, TP. Đà Nẵng để đánh giá các yếu tố pH, mật độ vi tảo và nồng độ ion Mn ban đầu ảnh hưởng đến hiệu quả loại bỏ Mn của tảo C. vulgaris.
2. Vật liệu và phương pháp nghiên cứu
2.1. Vật liệu nghiên cứu
Vi tảo C. vulgaris được phân lập từ tại quận Liên chiểu, TP. Đà Nẵng và nhân giống tại phòng thí nghiệm công nghệ Tảo, khoa Sinh – Môi trường, Trường Đại học Sư phạm – Đại học Đà Nẵng. Tảo được nhân giống trong môi trường Bold Basal Media (BBM) [8]trong bình thủy tinh có dung tích 500ml ml, ở nhiệt độ 250C, cường độ ánh sáng 1000 lux với chu kỳ chiếu sáng là 12:12. Khi tảo C.vulgaris đạt đến mật độ khoảng 10 x 106 tế bào/ml sẽ được thu sinh khối bằng máy li tâm (Hettich, model EBA 20). Dung dịch Mn được chuẩn bị từ Mn(NO3)2.
2.2. Phương pháp nghiên cứu
- Mật độ tế bào vi tảo được xác định băng buồng đếm Neubauer.
- Hàm lượng kim loại Mn còn lại sẽ được xác định bằng phương pháp quang phổ hấp phụ nguyên tử AAS trên máy Analytik Jena 700P.
- Hiệu quả loại bỏ kim loại được tính theo công thức:
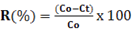
Trong đó:
R: là hiệu suất xử lý kim loại nặng (%)
Co: Nồng độ kim loại nặng ban đầu (mg/l)
Ct: Nồng độ kim loại nặng theo thời gian (mg/l)
- Xử lý số liệu: Tất cả thí nghiệm được lặp lại 03 lần. Số liệu thí nghiệm được phân tích thống kê mô tả và phân tích phương sai ANOVA với độ tin cậy 99% bằng phần mềm SPSS ver 18.
3. Kết quả nghiên cứu
3.1. Ảnh hưởng của mật độ ban đầu của vi tảo C. vulgaris đến khả năng xử lý Mn
Nghiên cứu ảnh hưởng mật độ vi tảo C. vulgaris đến khả năng xử lý Mn được bố trí thí nghiệm ở nồng độ ion Mn ban đầu là 75 mg/l với pH cố định bằng 6 và mật độ tế bào được bố trí lần lượt là 6,5 x 106tế bào/ml,10,5 x 106tế bào/ml và 14,5 x 106tế bào/ml. Kết quả cho thấy, hiệu suất xử lý kim loại Mn tăng dần theo thời gian và đạt cao nhất tại 120 giờ và có sự khác biệt có ý nghĩa giữa 03 loại mật độ với p-value <0.000. Hiệu suất xử lý đạt cao nhất ở mật độ 10,5 x 106tế bào/ml với 69,49 %, chỉ đạt 54,68 % ở mật độ 6,5 x 106tế bào/ml và thấp nhất 45,68 % ở mật độ 14,5 x 106tế bào/ml được trình bày trong Hình 1.
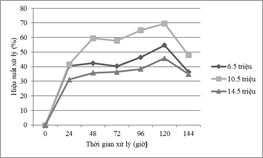
Hình 1. Ảnh hưởng của mật độ tế bào tảo
Kết quả trên cho thấy, hiệu suất xử lý ion kim loại Mn của tảo C. vulgarissẽ tăng khi mật độ tế bào từ 6,5 x 106tế bào/ml đến10,5 x 106tế bào/mlvà giảm khi mật độ tế bào lên đến 14,5 x 106. Điều này có thể giải thích là do khi tăng mật độ lên 10,5 x 106tế bào/ml thì sẽ làm tăng diện tích bề mặt hấp thụ các liên kết kim loại có sẵn trên tế bào. Tuy nhiên, mật độ tế bào tảo quá cao (14,5 x 106) sẽ làm giảm khoảng cách giữa các vị trí hấp phụ trên bề mặt tế tảo trên cùng một đơn vị thể tích [9].
3.2. Ảnh hưởng của nồng độ ion Mn ban đầu đến khả năng xử lý của vi tảo C. vulgaris
Để đánh giá ảnh hưởng của nồng độ Mn đến khả năng xử lý của tảo C. vulgaris, thí nghiệm được tiến hành ở pH 6.0, mật độ tế bào ban đầu là 10,5 x 106tế bào/ml. Nồng độ kim loạiion Mn ban đầu được sử dụng ở 03 mức là 35 mg/l, 50 mg/l và 65 mg/l. Kết quả phân tích thống kê cho thấy sự khác biệt có ý nghĩa giữa 03 nồng độ với p- value <0.000 tại thời điểm 120 giờ. Hình 2 cho thấy, hiệu suất xử lý ion kim loại Mn đạt cao nhất là 78,81% tại 35 mg/l, cao thứ 2 là 68,19 % (50 mg/l) và thấp nhất 65,09% (65 mg/l).
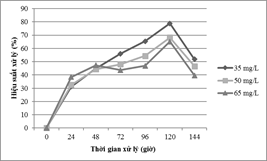
Hình 2. Ảnh hưởng của nồng độ ion Mn
Kết quả trên chỉ ra rằng nồng độ kim loại giảm thì hiệu quả loại bỏ sẽ tăng, điều này có thể giải thích là do ở nồng độ thấpcác ion tự do sẽ được tăng cường khả năng liên kết giữa với bề mặt của tảo[10].
3.3. Ảnh hưởng của pH đến khả năng xử lý Mn của vi tảo C. vulgaris
Nghiên cứu được tiến hành ở nồng độ Mn ban đầu là 35 mg/l và mật độ ban đầu là 10,5 x 106tế bào/ml với giá trị pH ban đầu là 4,0; 5,0 và 6,0. Kết quả phân tích thống kê cho thấy sự khác biệt có ý nghĩa với p- value <0.000 về hiệu suất xử lý giữa pH = 4, pH = 5 và pH = 6.Hình 3 cho thấy hiệu suất loại bỏ ion kim loại Mn sẽ giảm dần từ khoảng 80% ở pH = 6 xuống còn 61,61 % ở pH = 5 và chỉ đạt 47,42% ở pH = 4 tại thời điểm 120 giờ.
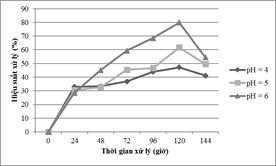
Hình 3. Ảnh hưởng pH
Điều này được giải thích là do khả năng hấp phụ của bề mặt tảo phụ thuộc vào nồng độ H+. Ở pH thấp, các nhóm chức trên bề mặt tảo sẽ liên kết với các ion H+, do đó làm cản trở các ion Mn liên kết với bề mặt của tảo [9].
4. Kết luận
Nghiên cứu tiến hành đánh các yếu tố mật độ ban đầu, nồng độ kim loại năng ban đầu và pH đến khả năng loại bỏ ion Mn bằng tảo C. vulgaris. Hiệu suất xử lý của tảo đạt cao nhất 80% ở mật độ 10,5 x 106tế bào/ml, nồng độ ion Mn ban đầu 35 mg/l và pH = 6. Nghiên cứu cũng chỉ ra, tiềm năng ứng dụng tảo C. vulgaristrong xử lý qui mô công nghiệp và xử lý các kim loại nặng khác.
Trần Ngọc Sơn
Trịnh Đăng Mậu
Trần Nguyễn Quỳnh Anh
Trịnh Minh Phượng
Đàm Minh Anh
Trường Đại học sư phạm - Đại học Đà Nẵng
(Nguồn: Bài đăng trên Tạp chí Môi trường, số Chuyên đề Tiếng việt 2/2020)
Lời cảm ơn: Nghiên cứu này được tài trợ bởi Quỹ Phát triển khoa học và công nghệ Đại học Đà Nẵng trong đề tài có mã sốB2018-ĐN03-28.
TÀI LIỆU THAM KHẢO
1 Li Y., “Removal of Manganese ( II ) from Acid Mine Wastewater: A Review of the Challenges and Opportunities with Special Emphasis on”.
2 Suresh Kumar K., Dahms H.U., Won E.J., Lee J.S., Shin K.H (2015). Microalgae - A promising tool for heavy metal remediation. Ecotoxicology and Environmental Safety.
3 Sandau E., Sandau P., Pulz O (1996). Heavy metal sorption by microalga. Acta Biotechnologica. vol. 16, no. 4, pp. 227–235.
4 Travieso L, Cañizares R.O, Borja R, Benítez F, Domínguez A.R, Dupeyrón R, Valiente Y. V (1999). Heavy metal removal by microalgae. Bulletin of Environmental Contamination and Toxicology, vol. 62, no. 2, pp. 144–151.
5 Çetinkaya Dönmez G, Aksu Z, Öztürk A, Kutsal T (1999). A comparative study on heavy metal biosorption characteristics of some algae. Process Biochemistry, vol. 34, no. 9, pp. 885–892.
6 Mallick N, Rai L.C (1993). Influence of culture density, pH, organic acids and divalent cations on the removal of nutrients and metals by immobilized Anabaena doliolum and Chlorella vulgaris. World Journal of Microbiology and Biotechnology, vol. 9, no. 2, pp. 196–201.
7 Lau P.S, Tam, Wong Y.S (1995). Effect of algal density on nutrient removal from primary settled wastewater. Environmental Pollution, vol. 89, no. 1, pp. 59–66.
8 Bishnoi N R, Pant A, Garima (2004). Biosorption of copper from aqueous solution using algal biomass. Journal of Scientific and Industrial Research, vol. 63, no. 10, pp. 813–816.
9 Andersen R A, Algal Culturing Techniques.
10 Esposito A, Pagnanelli F, Lodi A, Solisio C, Vegliò F (2001) “Biosorption of heavy metals by Sphaerotilus natans: An equilibrium study at different pH and biomass concentrations”, Hydrometallurgy, vol. 60, no. 2, pp. 129–141.
11 Monteiro C.M, Castro P.M.L, Malcata F.X (2012). Metal uptake by microalgae: Underlying mechanisms and practical applications. Biotechnology Progress, vol. 28, no. 2, pp. 299–311.
|
STUDY ON UPTAKE OF MANGAN ION BY CHLORELLA VULGARIS Tran Ngoc Son, Trinh Đang Mau, Tran Nguyen Quynh Anh, Trinh Minh Phuong, Đam Minh An] The University of Danang – University of Science and Education ABSTRACT Chlorella vulgaris (C. vulgaris) has been considered as a promising biosorbent material due to high sorption capacity and being ready availability in removal of heavy metals in wastewater. Mangan (Mn) is a common chemical that could cause serious problems for human health and ecosystem. Therefore, the present study was carried out to investigate effects of different environmental factors including initial cell density, initial concentrations of heavy meta and pH on the capacity of Mn removal by C. vulgaris. The experimental results showed the highest proportion (80%) of Mn removal was observed from aqueous solution with initial cell density of 10,5 x 106cells/mL, initial Mn concentration of 35 mg/l and pH = 6,0. Key Words: Microalgae; Chlorella vulgaris; Mangan. |