

03/11/2025
TÓM TẮT
Vitexin thuộc nhóm flavonoid chính được tìm thấy trong rất nhiều loài thực vật trong đó có vỏ hạt đỗ xanh, có hoạt tính sinh học đa dạng như chống oxy hóa, hạ đường huyết, giảm mỡ máu và bảo vệ tế bào thần kinh. Trong bài viết, nhóm nghiên cứu trình bày kết quả hoàn thiện quy trình tách chiết vitexin từ vỏ đỗ xanh ở quy mô 10 kg nguyên liệu/mẻ, dung môi ethanol 80% với tỷ lệ nguyên liệu: Dung môi là 1:3 (w/v), độ tinh sạch đạt 91,73% và hiệu suất tách chiết đạt 0,231%. Vitexin tách được có khả năng bắt giữ gốc tự do (IC50 đạt 226,06 ± 11,3 ppm), hoạt tính ức chế AChE (IC50 đạt 150,90 ± 4,5 ppm) và có hoạt tính bảo vệ tế bào chống lại độc tính gây ra bởi Aβ25-35. Các kết quả thu được cho thấy, vitexin tách chiết từ vỏ đỗ xanh đạt tiêu chuẩn để chế tạo nanovitexin, giúp tăng cường khả năng hấp thụ và hoạt tính sinh học, làm nguyên liệu cho sản xuất thực phẩm chức năng hỗ trợ phòng và điều trị các bệnh mãn tính.
Từ khóa: Bảo vệ thần kinh, chống oxy hóa, vitexin, vỏ đỗ xanh.
Ngày nhận bài: 5/8/2025; Ngày sửa chữa: 14/9/2025; Ngày duyệt đăng: 28/9/2025
Characterization and Neuroprotective Potential of Vitexin Isolated from Mung Bean coats (Vigna radiata L.)
ABSTRACT
Vitexin is a flavonoid of significant therapeutic interest, found in plants such as mung bean, and is recognized for its potent antioxidant, hypoglycemic and neuroprotective effects. In this study, we presented the successful optimization and implementation of a vitexin extraction process from mung bean coats. The procedure was conducted at a 10 kg raw material per batch scale, utilizing 80% ethanol solvent at a raw material-to-solvent ratio of 1:3 (w/v). The extracted vitexin achieved a purity of 91.73% and an extraction efficiency of 0.231%. The isolated vitexin exhibited significant biological activities, including potent antioxidant activity (IC50 of 226.06 ± 11.3 ppm) and AChE inhibitory activity (IC50 of 150.90 ± 4.5 ppm). Furthermore, it demonstrated cytoprotective activity against Aβ25-35-induced toxicity. The obtained results indicated that vitexin isolated from mung bean coats meets the necessary standards for the fabrication of nanovitexin, thereby enhancing its absorption and biological activity, serving as a raw material for producing functional of foods that support the prevention and treatment of chronic diseases.
Key words: Neuroprotection, antioxidant, vitexin, mung bean coats.
JEL Classifications: O13, Q15, Q57.
1. GIỚI THIỆU
Alzheimer là một chứng bệnh thoái hóa thần kinh liên quan đến tuổi tác, biểu hiện phổ biến nhất là mất trí nhớ. Bệnh này được đặc trưng bởi sự tích tụ các mảng bám amyloid beta (Aβ) ngoại bào và các đám rối tơ thần kinh (NFTs) nội bào, dẫn đến suy giảm chức năng của các tế bào thần kinh và gây chết tế bào [6]. Nguyên nhân chủ yếu là do sự sụt giảm đáng kể lượng acetylcholine (ACh) - một chất dẫn truyền thần kinh trung ương, truyền tín hiệu trong các khe synapsis. ACh bị thủy phân do acetylcholinesterase (AChE) thành choline và acetyl. AChE là enzym liên quan tới quá trình thủy phân acetylcholine, đóng vai trò quan trọng trong việc tạo mảng bám Aβ trong các bệnh như Alzheimer. Các loại thuốc dùng trong điều trị và kiểm soát bệnh Alzheimer chủ yếu liên quan đến ức chế cholinesterase, do đó ngăn cản quá trình thủy phân của ACh [13], tuy nhiên, các loại thuốc này thường có tác dụng phụ không mong muốn như buồn nôn, chóng mặt…Vì vậy, việc tìm kiếm các sản phẩm tự nhiên, giàu dinh dưỡng và có tác dụng bảo vệ thần kinh, ít hoặc không có tác dụng phụ so với thuốc tổng hợp đã trở nên cần thiết.
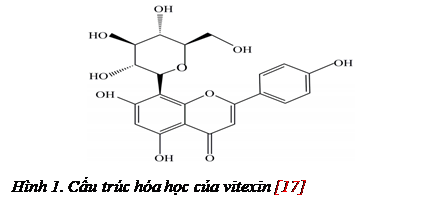
Vitexin (Apigenin-8-C-glucoside), là một hợp chất tự nhiên thuộc nhóm flavonoid, có chứa liên kết C-glycoside - chứa các nhóm đường liên kết với các-bon của aglycone, thường ở dạng C-8 tạo thành liên kết C-C, giúp chúng không bị thủy phân bởi axit ở ruột [13] (Hình 1). Trong hơn hai thập kỷ qua, vitexin đã thu hút được sự quan tâm đáng kể của các nhà nghiên cứu bởi hoạt tính sinh học đa dạng của nó như chống oxy hóa, hạ đường huyết, giảm mỡ máu, kháng khuẩn [13] và bảo vệ tế bào thần kinh [12]. Vitexin rất khó tan trong nước, chỉ tan một số dung môi hữu cơ như DMSO, ethanol [1]. và được chuyển hóa chủ yếu ở ruột (chiếm 94%), dạ dày (chiếm 30%), gan (chiếm 5%) và nhanh chóng phân bố vào các mô khác nhau, cuối cùng chúng được bài tiết thông qua nước tiểu và mật [13].
Hu và cộng sự (2016) đã chỉ ra vitexin có khả năng ức chế AChE, giúp tăng cường khả năng tồn tại của tế bào thần kinh bằng cách tăng tỷ lệ Bc2/Bax và điều chỉnh giảm các caspases, kích hoạt con đường phosphatidylinositol-3-OH kinase (PI3K) - protein kinase B (Akt) [4]. Quá trình peroxy hóa lipid, oxy hóa protein và mất màng ty thể là những tổn thương oxy hóa điển hình đối với tế bào nơron, vitexin có tầm quan trọng lớn trong việc bảo vệ các vùng não khỏi các tổn thương do stress oxy hóa [10]. Kim và cộng sự (2019) cho thấy vitexin có có tác dụng cải thiện về các bệnh lý liên quan tới thần kinh và trí nhớ, làm giảm chứng rối loạn giấc ngủ và các bệnh thoái hóa thần kinh [7].
Đậu xanh (Vigna radiata L.) được coi là nguồn cung cấp vitexin tiềm năng nhất so với các nguồn thực vật khác. Vitexin và isovitexin là hai flavonoid chính được tìm thấy ở vỏ đỗ xanh, chiếm 95,6% và 96,8% tổng lượng vitexin và isovitexin có trong đậu xanh, với hàm lượng đạt 37,43 và 47,18 mg/g, tương ứng [13]. Vỏ đỗ xanh là nguồn phụ phẩm được tạo ra trong quá trình chế biến và được bổ sung chủ yếu làm thức ăn cho chăn nuôi gia súc, gia cầm và thủy sản. Với nguồn nguyên liệu phổ biến, sản lượng lớn, chất lượng ổn định và giá thành thấp thì hướng nghiên cứu tách chiết vitexin từ vỏ đỗ xanh là mang tính khả thi giúp làm giảm giá thành của sản phẩm, nâng cao giá trị khai thác của cây đậu xanh và đồng thời góp phần bảo vệ môi trường. Trong nghiên cứu này, nhóm nghiên cứu xin trình bày các kết quả nghiên cứu hoàn thiện quy trình tách chiết vitexin từ vỏ đỗ xanh ở quy mô 10 kg nguyên liệu/mẻ, đánh giá tác dụng chống oxy hóa, ức chế AChE và hoạt tính bảo vệ tế bào thần kinh C6 chống lại độc tính tế bào trên mô hình bệnh Alzheimer được cảm ứng bởi Amyloid β-Protein Fragment 25-35 (Aβ25-35) trên dòng tế bào thần kinh C6 của vitexin tách chiết được, làm nguyên liệu cho sản xuất thực phẩm chức năng có nguồn gốc tự nhiên trong phòng và điều trị các bệnh mãn tính.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng:
Vỏ đỗ xanh khô được thu mua từ các hộ gia đình ở Ba Vì, Hà Nội, sau đó đem xay nhỏ, mịn và được bảo quản ở nơi thoáng mát, tránh ánh sáng mặt trời.
- Vitexin thương mại (độ sạch ≥99,8%); Amyloid β-Protein Fragment 25-35(Aβ25-35) (độ tinh sạch ≥ 97%, No. A.4559); 1,1-Diphenyl-2-picrylhydrazyl Free Radical (DPPH) (C18H12N5O6); Dimethyl Sulfoxide (DMSO) ((CH3)2SO); 3-4,5-dimethylthiazol-2-yl-2,5-diphenyltetrazolium bromide (MTT) và axít Ascorbic (Vitamin C) (Sigma, Mỹ). Galantamine hydrobromid (Sopharma AD, Bulgaria); Dung môi hữu cơ như Ethanol, Methanol, Ethyl acetate, Dichloromethane và Acetone ( Xilong, Trung Quốc) và sắc ký bản mỏng (Merck, Mỹ).
- Dòng tế bào u thần kinh đệm chuột C6 (C6 rat glioma cell line, American Type Culture Collection - ATCC, cat. No. CCL-107) do TS. Nguyễn Văn Trữ, Viện Sinh học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam cung cấp. Tế bào được nuôi cấy trong tủ nuôi cấy vô trùng 37◦C, 5% CO2, trong môi trường DMEM/high glucose bổ sung thêm 10% FBS, 100 U/mL Penicillin và 0,1 mg/mL Streptomycin (Thermo Fisher Scientific, Mỹ).
2.2. Phương pháp nghiên cứu
2.2.1. Tách chiết vitexin từ vỏ đỗ xanh quy mô 10 kg nguyên liệu/ mẻ
10 kg nguyên liệu vỏ đỗ xanh được đặt vào bể siêu âm và bổ sung ethanol 80% theo tỉ lệ 1:3 (w/v), siêu âm ở nhiệt độ phòng trong 2 giờ và thu dịch chiết. Quá trình này được lặp lại thêm 2 lần. Dịch chiết được cất loại dung môi bằng máy cô quay ở nhiệt độ 60oC xuống còn 1/20 thể tích ban đầu thu được dịch chiết cô đặc. Dịch cô đặc để trong ngăn mát tủ lạnh qua đêm sẽ xuất hiện kết tủa dưới dạng bột màu vàng. Lọc thu riêng tủa và phần dịch. Chiết phân bố phần dịch lọc bằng ethyl acetate 3 lần, mỗi lần dùng 500 mL dung môi, thu dịch chiết EtOAc và cất loại hết dung môi thu được cặn chiết ethyl acetate dưới dạng chất bột màu đen. Gộp chung kết tủa và căn chiết cặn chiết EtOAc của dịch lọc thu được sản phẩm vitexin thô.
2.2.2. Tinh sạch và xác định cấu trúc và định lượng của vitexin
Sản phẩm vitexin thô (ký hiệu VT1) được rửa bằng dung môi Dichloromethane và Acetone thu được chất bột màu vàng. Kết tinh lại chất bột màu vàng này bằng ethanol 80% nóng thu được sản phẩm dưới dạng chất bột màu vàng.
- Xác định cấu trúc của vitexin bằng phương pháp chạy sắc kí lớp mỏng (TLC): Chạy sắc kí lớp mỏng của mẫu vitexin thô và so sánh với chất chuẩn vitexin (Sigma, Mỹ) với hệ dung môi EtOAc:MeOH:H2O (4:1:0,1, v/v/v). Quan sát vệt chất dưới ánh sáng thường và dưới ánh sáng UV ở bước sóng UV 254 nm và hiện màu bằng thuốc thử Cerisunphat.
- Xác định cấu trúc bằng phương pháp phổ cộng hưởng từ hạt nhân NMR: Sử dụng máy cộng hưởng từ hạt nhân Bruker Advance. Phổ 1H NMR đo ở tần số 500 MHz và 13C NMR đo ở tần số 125 MHz trong dung môi DMSO-d6 với TMS làm chất chuẩn nội.
- Định lượng hàm lượng vitexin trong mẫu bằng HPLC với điều kiện chạy HPLC cụ thể như sau: Hệ thống HPLC 1260 Infinity II của hãng Agilent; Cột Hydrosphere C18; Kích thước 4.6 x 250 mm; Thể tích tiêm 1 µL Detector DAD; Tốc độ dòng 0,5 ml/min; Kênh A: H2O (80%); Kênh B: ACN (20%) và nhiệt độ: 25ºC. Công việc được thực hiện tại Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam.
2.2.3. Đánh giá hoạt tính sinh học của vitexin
- Xác định hoạt tính chống oxy hóa theo phương pháp DPPH: Hoạt tính trung hòa gốc tự do được xác định theo công bố của Sharma and Bhat (2009) [14]. DPPH là một gốc tự do có màu tím, khi có mặt chất chống oxy hóa, nó sẽ bị khử thành 2,2-Diphenyl-1-picrylhydrazine (DPPH-H), có màu vàng. Hỗn hợp phản ứng gồm 100 μL DPPH (nồng độ 0,2 μM) và 100 μL vitexin (ở các nồng độ 20, 50, 100 và 200 μg/mL). Hỗn hợp phản ứng được ủ trong tối ở nhiệt độ phòng trong thời gian 30 phút. Sau đó, đo mật độ quang (OD - Optimal Density) của DPPH ở bước sóng 517 nm cho phép xác định khả năng khử gốc DPPH của chất chống oxy hóa. Chất đối chứng dương được sử dụng là axít ascorbic ở nồng độ khảo sát 0,8; 4, và 20 μg/mL. Khả năng trung hòa gốc oxy hóa tự do (Scavenging Activities - SA) sinh ra từ DPPH của mẫu thử được tính theo công thức sau:
% SA = (OD đối chứng – OD mẫu thử) *100/OD đối chứng (%).
Trong đó: OD đối chứng : Độ hấp thụ tại giếng không chứa chất thử; OD mẫu thử : Độ hấp thụ tại giếng chứa chất thử. Giá trị IC50 (Half maximal Inhibitory Concentration) được tính dựa vào đường chuẩn y = ax + b. Hoạt tính chống oxy hóa của mẫu càng cao, thể hiện qua giá trị IC50 loại bỏ gốc tự do càng nhỏ.
- Đánh giá độc tính tế bào của vitexin trên dòng tế bào thần kinh C6: Hoạt tính bảo vệ tế bào trên dòng tế bào thần kinh C6 của VT1 (vitexin tách từ vỏ đỗ xanh) và VT2 (vitexin thương mại) được tiến hành như mô tả của Lưu Thị Tâm và cộng sự (2022) [16]. VT1 và VT2 được sử dụng ở các nồng độ 0,04; 0,5; 1; 5; 10, 20; 30; 50 và 100 μg/mL. Công thức đối chứng sử dụng là DMSO. Chất chuẩn Galantamine (100 μg/mL) được sử dụng làm đối chứng dương.
- Xác định tác dụng bảo vệ thần kinh của vitexin ở mô hình Alzheimer trên dòng tế bào thần kinh C6 gây tổn thương bằng Aβ25-35: Tác dụng bảo vệ tế bào chống lại độc tính gây ra bởi Aβ25-35 trên dòng tế bào thần kinh C6 của VT1và VT2 được tiến hành như mô tả của Lưu Thị Tâm và công sự (2022) [16]. Dịch chiết được sử dụng ở các nồng độ 30 và 50 μg/mL. DMSO được sử dụng làm đối chứng, chất chuẩn Galantamine (100 μg/mL) được sử dụng làm đối chứng dương. Cụ thể: tế bào C6 được nuôi cấy 24 giờ trong đĩa nuôi cấy 96 giếng có chứa môi trường DMEM/high glucose ở mật độ 1 x 105 tế bào/giếng. Sau 24 giờ, tiến hành loại bỏ môi trường cũ và bổ sung 100 µL môi trường DMEM/high glucose mới và bổ sung 1 µL DMSO hoặc 1 µL dịch chiết của VT1/VT2 (với các nồng độ thử nghiệm 30 và 50 µg/mL) và tiếp tục nuôi cấy trong 24 giờ. Sau đó, tế bào được bổ sung dung dịch Aβ25-35 để đạt nồng độ cuối cùng trong môi trường là 20 μM và tiếp tục nuôi cấy trong 2 giờ. Thí nghiệm có 3 nhóm gồm đối chứng là DMSO; mô hình gồm DMSO + Aβ25-35 và thí nghiệm gồm có dịch chiết VT1/VT2/Galantamine + Aβ25-35. Mỗi công thức thí nghiệm được lặp lại 3 lần. Hiệu quả bảo vệ tế bào thần kinh C6 gây tổn thương bằng Aβ25-35 (stress oxy hóa) được đánh giá dựa trên tỷ lệ sống sót của tế bào theo phương pháp 3-4,5-dimethylthiazol-2-yl-2,5-diphenyltetrazolium bromide (MTT) với mật độ quang được đo ở bước sóng 570 nm. Phần trăm sống sót của tế bào C6 được tính toán theo công thức: % tế bào sống sót = [OD570nm thí nghiệm/ OD570nm đối chứng] x 100% [16].
- Xác định khả năng ức chế AChE theo phương pháp so màu: Hoạt tính ức chế AChE của VT1 và VT2 được thực hiện theo kit Acetylchlolinesterase Inhibitor Screening Kit (MAK324, Sigma, Mỹ) theo hướng dẫn của nhà sản xuất. Cơ chất acetylthiocholin iodid (ACTI) bị thủy phân nhờ xúc tác của AChE tạo thiocholin. Sản phẩm thiocholin phản ứng với thuốc thử DTNB tạo thành hợp chất acid 5-thio-2-nitro benzoic có màu vàng. Dựa vào xác định độ hấp thụ của mẫu thử ở bước sóng 412 nm để đánh giá hoạt tính của AChE. Mẫu VT1 và VT2 được hòa tan trong DMSO với dải nồng độ 50 μg/mL. Sau đó, bổ sung hỗn hợp gồm 140 µL dung dịch đệm phosphate buffer (pH 8), 20 µL mẫu thử ở các nồng độ và 20 µL enzym AChE 0,25 IU/mL vào giếng thí nghiệm. Hỗn hợp được trộn đều và ủ ở 25oC trong 15 phút. Tiếp theo, 10 µL DTNB 2,5 mM và 10 µL ACTI 2,5 mM được đưa vào các giếng thí nghiệm và tiếp tục ủ trong 10 phút ở 25oC. Cuối cùng, dung dịch được đo độ hấp thu ở bước sóng 412 nm. Phần trăm ức chế hoạt độ enzym AChE (%I) được tính theo công thức: %I = ((Ac-At)/(Ac))*100%. Trong đó: % I: Phần trăm hoạt tính AChE bị ức chế; Ac: Độ hấp thu của mẫu chứng (không chứa 20 µL dung dịch thử) đã trừ độ hấp thu của giếng Blank; Ac: Độ hấp thu của mẫu thí nghiệm đã trừ độ hấp thu của giếng Blank.
2.2.4. Xử lý số liệu
Các số liệu nghiên cứu được xử lý thống kê theo phần mềm Microsoft excel 2013. Số liệu được biểu diễn dưới giá trị trung bình ± độ lệch chuẩn (X ± SD). Sự sai khác giữa các mẫu được đánh giá bằng phân tích ANOVA một yếu tố ở mức ý nghĩa p < 0,05.
3. KẾT QUẢ NGHIÊN CỨU VÀ THẢO LUẬN
3.1. Hoàn thiện quy trình tách chiết vitexin từ vỏ đỗ xanh quy mô 10 kg nguyên liệu/mẻ
Kế thừa kết quả nghiên cứu tách chiết vitexin từ vỏ đỗ xanh của các nghiên cứu đi trước [11], nhóm nghiên cứu đã hoàn thiện quy trình tách chiết vitexin ở quy mô 10 kg nguyên liệu/mẻ nhằm nâng quy mô, hiệu suất tách chiết và độ sạch của vitexin thu được (Hình 2) với một số thay đổi bao gồm ngâm chiết vỏ đỗ xanh trong dung môi ethanol: Nước (80:20, v/v) và siêu âm trong 2 giờ, ở nhiệt độ phòng, giúp cho dung môi thẩm thấu sâu hơn vào nguyên liệu; dịch cô quay thu được sẽ được tủa và làm lạnh qua đêm để thu được kết tủa dạng bột màu vàng (vitexin thô) và phần dịch. Phần dịch đó được lọc bằng ethyl acetate 3 lần để thu được vitexin thô, sau đó được rửa bằng dung môi dichloromethane và kết tinh bằng ethanol 80% nóng để thu được vitexin tinh sạch. Vitexin thu được là chất bột, có màu vàng chanh, khó tan trong nước và ancol, tan tốt trong DMSO. Kết quả cho thấy, hàm lượng vitexin thu được ở quy mô 10 kg nguyên liệu/mẻ theo quy trình hình mô tả ở trên có độ tinh sạch đạt 91,73% với hiệu suất đạt là 0,231%.
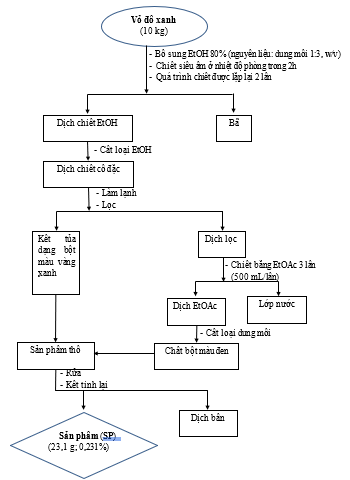
Hình 2. Quy trình tách chiết vitexin từ vỏ đỗ xanh quy mô 10 kg nguyên liệu/mẻ
3.2. Phân tích và xác định cấu trúc của vitexin thu được
Khi phân tích tích bằng sắc kí lớp mỏng (TLC) thì vết chất vitexin xuất hiện tại Rf = 0,6 (hệ dung môi EtOAc:MeOH:H2O (4:1:0.1)). Vitexin có màu vàng khi quan sát dưới ánh sáng thường, hiện màu tím khi quan sát dưới ánh sáng UV ở bước sóng 254 nm. Khi hiện màu bằng thuốc thử H2SO4 10%, vitexin cho màu vàng và màu xanh lục với thuốc thử Cerisunphat.
Phổ 1H NMR của VT1 xuất hiện tín hiệu của 4 proton dưới dạng một hệ tương tác spin-spin dạng A2B2 của một vòng benzen thế para tại δH 6,89 (2H, d, J = 8,0 Hz) và 8,01 (2H, d, J = 8,0 Hz); 2 proton thuộc vòng thơm khác dưới dạng singlet tại δH 6,27 (1H, s) và 6,75 (1H, s) cùng với 7 proton của một đơn vị đường tại δH 3,36-4,92. Ngoài ra, phổ 1H NMR còn xuất hiện tín hiệu đặc trưng cho proton thuộc nhón 5-OH của khung flavonoid tại δH 13,14. Phổ 13C NMR xuất hiện tín hiệu của 21 các-bon đặc trưng cho một khung flavonoid glycoside với 15 các-bon của khung flavonoid tại δC 98,12; 102,41; 104,01; 104,59; 115,78 (2C); 121,58; 128,93 (2C); 155,97; 160,36; 161,10; 162,54; 163,93 và 182,06; 6 các-bon còn lại thuộc về một đơn vị đường tại δC 61,28; 70,53; 70,82; 73,35; 78,64 và 81,80. Các dữ liệu phổ 1H NMR và 13C NMR cho phép nhận định VT1 là một hợp chất flavonoid C-glycoside. So sánh các số liệu phổ 1H NMR và 13C NMR của sản phẩm tách chiết VT1 với số liệu đã được công bố cho các hợp chất flavonoid C-glycoside. Sự phù hợp giữa các số liệu phổ của sản phẩm với các số liệu tương ứng của hợp chất vitexin (Bảng 1) được công bố [9], Jayasinghe và cộng sự (2004) [5] cho phép khẳng định cấu trúc của sản phẩm VT1 chiết tách được từ vỏ đỗ xanh chính là vitexin.
Bảng 1. Số liệu phổ 1H NMR và 13C NMR của và vitexin
|
|
Vitexin (tham khảo tài liệu) |
VT1 (tách từ vỏ đỗ xanh) |
||
|
C |
#dC |
#dH |
a,bdC |
a,cdH |
|
2 |
163,9 |
- |
163,93 |
- |
|
3 |
102,4 |
6,75 (s) |
102,41 |
6,75 (s) |
|
4 |
182,0 |
- |
182,06 |
- |
|
5 |
161,0 |
- |
161,10 |
- |
|
6 |
98,1 |
6,27 (s) |
98,12 |
6,27 (s) |
|
7 |
162,5 |
- |
162,54 |
- |
|
8 |
104,6 |
- |
104,59 |
- |
|
9 |
155,9 |
- |
155,97 |
- |
|
10 |
104,0 |
- |
104,01 |
- |
|
1’ |
121,5 |
- |
121,58 |
- |
|
2’ |
128,8 |
8,01 (d, 8,4) |
128,93 |
8,01 (d, 8,0) |
|
3’ |
115,7 |
6,86 (d, 8,4) |
115,78 |
6,89 (d, 8,0) |
|
4’ |
160,3 |
- |
160,36 |
- |
|
5’ |
115,7 |
6,86 (d, 8,4) |
115,78 |
6,89 (d, 8,0) |
|
6’ |
128,8 |
8,00 (d, 8,4) |
128,93 |
8,01 (d, 8,0) |
|
Phần glucose |
||||
|
1” |
73,3 |
4,69 (d, 9,9) |
73,35 |
4,69 (d, 10,0) |
|
2” |
70,8 |
|
70,82 |
3,85 (t, 9,0) |
|
3” |
78,8 |
|
78,64 |
|
|
4” |
70,5 |
|
70,53 |
|
|
5” |
81,7 |
|
81,80 |
|
|
6” |
61,3 |
|
61,28 |
|
|
5-OH |
|
13,14 (s) |
|
13,14 (s) |

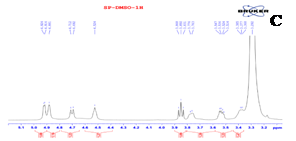
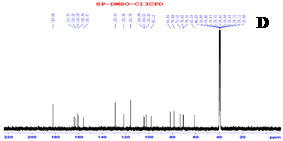
Hình 3. Phổ 1H NMR của vitexin (A); Phổ 1H NMR giãn rộng của vitexin (B); Phổ 1H NMR giãn rộng của vitexin (tiếp) (C); Phổ 13C NMR của vitexin (D)
Theo tác giả Nguyễn Thị Thu Hà và cộng sự (2019) [11], vitexin tách chiết từ vỏ đỗ xanh với quy mô 7 kg/mẻ, sử dụng dung môi ethanol 70%, ngâm tĩnh thu được hiệu suất tách chiết là 0,027% và độ tinh sạch khoảng 80%. Kết quả tách chiết của chúng tôi thu được hiệu suất tăng gấp khoảng 10 lần và độ tinh sạch cao hơn. Tuy nhiên, theo Zafari và cộng sự (2020) [18], vitexin tách từ Prosopis farcta ở quy mô 2 g nguyên liệu/mẻ với hệ dung môi metanol-nước (40%, chứa axit axetic 0,5%) cho hiệu suất 0,554%. Ding và cộng sự (2021) [2], vitexin tách từ cây táo gai quy mô 1 g lá táo gai với 50 mL ethanol 60% trong 30 phút trong bể siêu âm, quá trình chiết được lặp lại hai lần với 25 mL ethanol 60% thu được độ tinh sạch trên 95%, hiệu suất 0,47%. Kết quả tách chiết của các công bố trên đều cho độ tinh sạch cao hơn, cùng hiệu suất cao gấp khoảng 2 lần so với kết quả của chúng tôi nhưng quy mô chỉ dừng lại ở 1-2 g nguyên liệu/mẻ, rất khó thực hiện khi triển khai ở quy mô pilot. Do vậy, quy trình của nhóm nghiên cứu đưa ra ở quy mô 10 kg nguyên liệu/mẻ đáp ứng được nhu cầu thực tế để tách chiết lượng lớn vitexin, chủ động tách chiết nguyên liệu vitexin đáp ứng nhu cầu của thị trường.
3.3. Hoạt tính chống oxy hóa của vitexin
Hoạt tính chống oxy hóa của VT1 và VT2 được tiến hành thử nghiệm với dải nồng độ từ 20-200 ppm được trình bày ở Hình 4. Kết quả cho thấy chất chuẩn axit ascorbic có hoạt tính thu dọn gốc tự do mạnh với giá trị IC50 là 12,47 ± 0,62 ppm. Kết quả chỉ ra ở Hình 4 cho thấy giá trị IC50 của VT1 và VT2 lần lượt đạt 226,06 ± 11,3 ppm và 215,83 ± 10,79 ppm, không có sự sai khác có ý nghĩa thống kê sinh học (p > 0,05) . Như vậy, hoạt tính chống oxy hóa của vitexin tách từ vỏ đỗ xanh là tương đương với vitexin thương mại, điều này cho thấy quy trình tách chiết vitexin ở quy mô 10 kg nguyên liệu/mẻ có hiệu quả cao và vitexin thu được có chất lượng tốt.
Kết quả này tương đồng với công bố của Sun và cộng sự (2013) [15], khi đánh giá hoạt tính chống oxy hóa của vitexin tách từ hoa của cây Trollius chinensis Bunge với giá trị IC50 đạt 217,9 ± 2,7 ppm. Tuy nhiên, theo công bố của Kim và cộng sự (2005) [8] thì vitexin tách từ loài Acer palmatum thể hiện hoạt tính chống oxy hóa cao với giá trị IC50 đạt 84 ppm. Sự sai khác này có thể là do khác biệt về nguồn nguyên liệu, dung môi và phương pháp tách chiết vitexin.
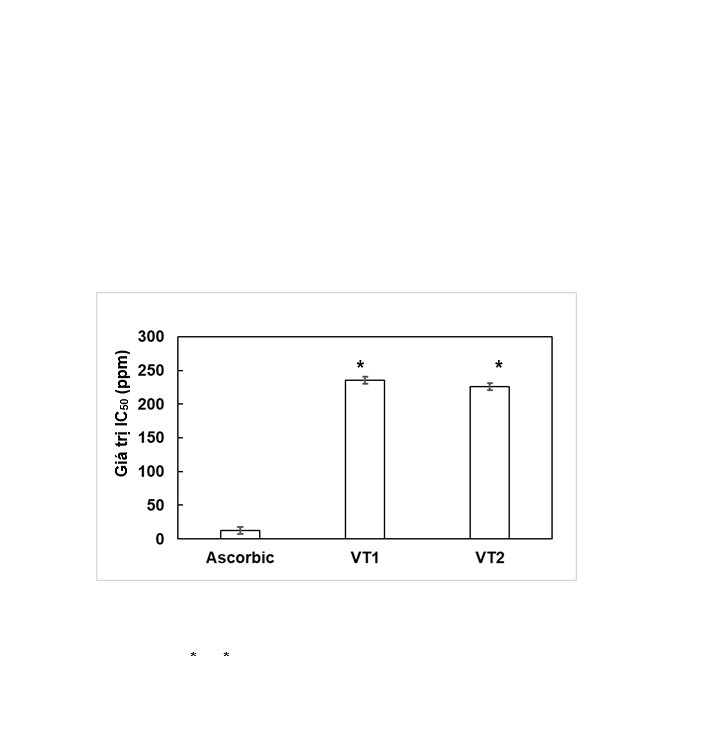
Hình 4. Khả năng chống oxy hóa của vitexin được thể hiện qua giá trị IC50
Ghi chú: VT1: vitexin tách chiết từ vỏ đỗ xanh; VT2: vitexin thương mại; * số liệu có xử lý thống kê với sự sai khác p<0,05
3.4. Đánh giá độc tính tế bào của vitexin trên dòng tế bào thần kinh C6
Kết quả đánh giá độc tính của mẫu vitexin tách chiết từ vỏ đỗ xanh với dải nồng độ từ 0,04– 100 μg/mL trên dòng tế bào C6 được trình bày ở Hình 5A. Kết quả cho thấy, DMSO làm mẫu đối chứng và xem tỷ lệ sống sót của tế bào thần kinh C6 là 100%, dùng làm tham chiếu cho các mẫu thử nghiệm. Tế bào C6 được cảm ứng bằng VT1 và VT2 có tỷ lệ sống sót cao nhất với dải nồng độ thử nghiệm từ 0,04 -50 μg/mL, dao động từ 97,2± 4,66% đến 102 ± 4,02%. Như vậy, vitexin không có khả năng gây độc tế bào C6 ở nồng độ tối đa là 50 μg/mL, tỷ lệ sống sót này sẽ thay đổi tùy theo dòng tế bào thử nghiệm. Kết quả này phù hợp với nghiên cứu Ding và cộng sự (2021) [2], vitexin từ cây táo gai với độ tinh sạch trên 95%, sau đó tiến hành đánh giá độc tính của vitexin tách được trên dòng tế bào gan BRL-3A và cho kết quả tế bào an toàn với nồng độ vitexin dưới 1.000 μg/mL. Ngoài ra, kết quả này cũng tương đồng với nghiên cứu của Thenmozhi và Subasini (2016) cho thấy vitexin an toàn đối với dòng tế bào L6 bình thường nhưng gây độc đáng kể đối với dòng tế bào MCF-7 tỷ lệ sống sót của tế bào tại nồng độ 10 μg/mL là 75,48 ± 1,15 %. Như vậy, kết quả của nhóm nghiên cứu tương đồng với những công bố nêu trên đều khẳng định hoạt tính không gây độc đáng kể của vitexin, nồng độ gây độc tùy thuộc vào từng loại tế bào và phương pháp tách chiết khác nhau. Do đó, vitexin tách chiết từ vỏ đỗ xanh cũng được xem là nguyên liệu tiềm năng có thể dùng trong các sản phẩm thực phẩm chức năng, có tác dụng bảo vệ thần kinh.
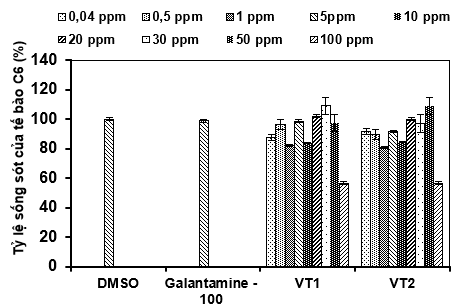
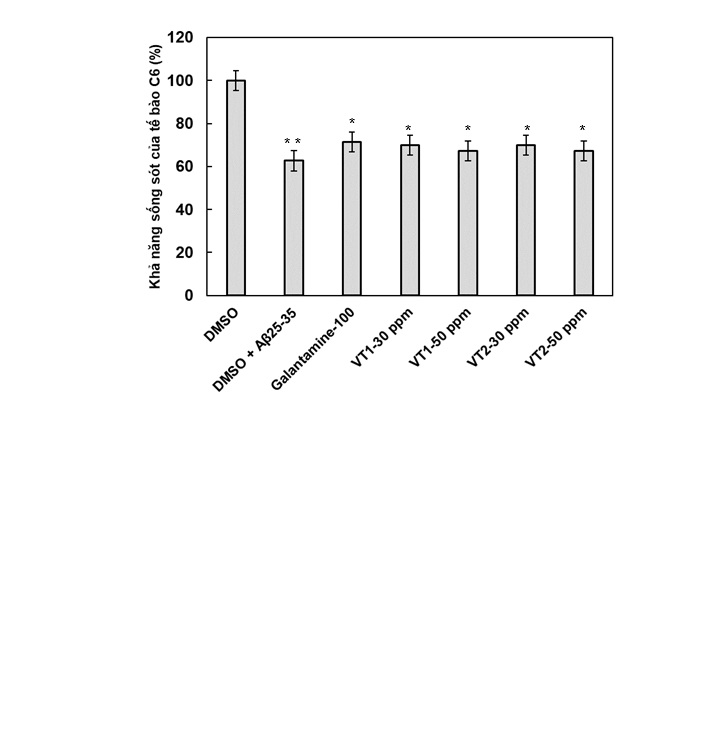
Hình 5. Độc tính tế bào (A) và tác dụng bảo vệ tế bào thần kinh C6 ở mô hình bệnh Alzheimer cảm ứng bằng Aβ25-35 (B) của vitexin ở các nồng độ khác nhau
3.5. Đánh giá tác dụng bảo vệ tế bào thần kinh C6 trên mô hình bệnh Alzheimer được gây cảm ứng bằng Aβ25-35
Kết quả trình bày ở Hình 5B cho thấy, khi các tế bào C6 cảm ứng bởi Aβ25-35 đã làm giảm tỷ lệ sống sót của tế bào xuống 65,40% so với công thức đối chứng (các tế không được xử lý Aβ25-35 xem như có tỷ lệ sống sót 100%). Khi có mặt của VT1/VT2 ở các nồng độ khác nhau đã có ảnh hưởng tích cực tới tỷ lệ sống sót của tế bào C6. Trong đó ở nồng độ 30 và 50 µg/mL, VT1 và VT2 có khả năng bảo vệ tế bào C6 khi cảm ứng bằng Aβ25-35 với phần trăm tế bào sống sót là 76,94% và 71,65%; 75,35 và 73,45%, tương ứng (cao hơn 65,40% ở nhóm mô hình DMSO + Aβ25-35). Galantamine được sử dụng như chất đối chứng dương trong mô hình gây bệnh Alzheimer có khả năng bảo vệ tế bào khỏi độc tính do Aβ25-35 gây ra với tỷ lệ sống sót của tế bào đạt 72,25%. Các kết quả sơ bộ cho thấy vitexin có khả năng bảo vệ tế bào thần kinh trước tác nhân gây stress như Aβ25-35 và hoạt tính này phụ thuộc vào nồng độ thử nghiệm.
3.6. Hoạt tính ức chế AChE của vitexin
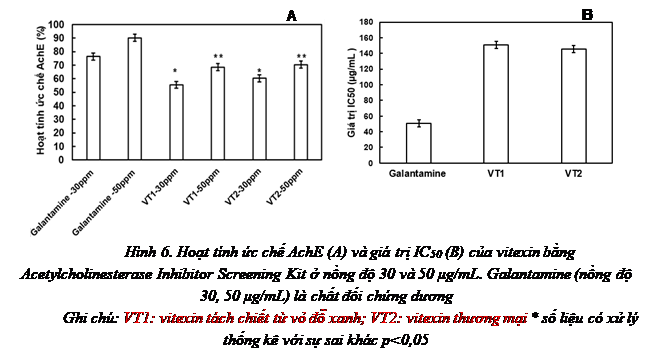
Hình 6. Hoạt tính ức chế AchE (A) và giá trị IC50 (B) của vitexin bằng Acetylcholinesterase Inhibitor Screening Kit ở nồng độ 30 và 50 μg/mL. Galantamine (nồng độ 30, 50 μg/mL) là chất đối chứng dương
Phần trăm ức chế AChE của VT1, VT2 (30 và 50 µg/mL) được trình bày ở Hình 6A. Kết quả thu được cho thấy, VT1 và VT2 có hoạt tính ức chế AChE dao động từ 55,46% đến 70,44% tùy thuộc vào nồng độ của vitexin thử nghiệm. Ở nồng độ 50 µg/mL, VT1 và VT2 có hoạt tính ức chế AChE cao nhất đạt 68,58 và 70,44%, tương ứng và được coi là chất ức chế AChE mạnh theo khóa phân loại của Vinutha và cộng sự (2017) [17]. Chất đối chứng dương galantamine có hoạt tính ức chế AChE là 75,5% và 90,23% ở nồng độ 30 và 50 µg/m, tương ứng - được coi là chất ức chế AChE mạnh. Kết quả chỉ ra trên hình 6B cho thấy Galantamine có giá trị IC50 đạt 42,5 μg/mL, giá trị IC50 của VT1 và VT2 đạt 150,90 và 145,50 μg/mL, tương ứng. Các chất ức chế AChE được coi là tác nhân điều trị quan trọng để kiểm soát bệnh Alzheimer. Kết quả thu được đã chứng minh vitexin tách chiết từ vỏ đỗ xanh có tiềm năng ức chế AChE.
4. KẾT LUẬN
Nhóm nghiên cứu đã hoàn thiện được quy trình tách chiết vitexin từ vỏ đỗ xanh quy mô 10 kg nguyên liệu/mẻ, dung môi ethanol 80% với tỉ lệ nguyên liệu: Dung môi là 1:3 (w/v) với độ tinh sạch đạt 91,73% và hiệu suất đạt 0,231%. Vitexin tách được có hoạt tính chống oxy hóa (IC50 đạt 226,06 ± 11,3 ppm), hoạt tính ức chế AChE (IC50 đạt 150,90 ± 4,5 ppm) và có tác dụng bảo vệ tế bào thần kinh C6 ở mô hình Alzheimer gây tổn thương bằng Aβ25-35. Các kết quả thu được cho thấy, vitexin tách chiết từ vỏ đỗ xanh đạt tiêu chuẩn để chế tạo nanovitexin, giúp tăng cường khả năng hấp thụ và hoạt tính sinh học, làm nguyên liệu cho sản xuất thực phẩm chức năng hỗ trợ phòng và điều trị các bệnh mãn tính.
Lời cảm ơn: Nghiên cứu được hỗ trợ kinh phí từ Đề tài: “Nghiên cứu quy trình công nghệ chế tạo nanovitexin làm nguyên liệu sản xuất thực phẩm bảo vệ sức khỏe hỗ trợ trong phòng và điều trị bệnh tiểu đường” mã số UDPTCN. 03/22-24 do TS. Ngô Thị Hoài Thu, Viện Sinh học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam làm chủ nhiệm năm 2022-2025.
Ngô Thị Hoài Thu1, 4*, Nguyễn Thị Minh Hằng2, 4, Hà Phương Thư 3, 4, Phan Kế Sơn3, Nguyễn Văn Trữ1
1Viện Sinh học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam
2Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam
3Viện Khoa học Vật liệu, Viện Hàn lâm Khoa học và Công nghệ Việt Nam
4Học viện Khoa học và Công nghệ, Viện Hàn lâm Khoa học và Công nghệ Việt Nam
(Nguồn: Bài đăng trên Tạp chí Môi trường số Chuyên đề Khoa học - Công nghệ III/2025)
TÀI LIỆU THAM KHẢO
1. Abdulai IL et al., 2021. Multitargeted Effects of Vitexin and Isovitexin on Diabetes Mellitus and Its Complications. The Scientific World Journal, pp 20.
2. Ding C et al., 2021. Protective effect of hawthorn vitexin on the ethanol-injured DNA of BRL-3A hepatocytes. Medicine, 100(50), pp. 1-7. doi: 10.1097/MD.0000000000028228.
3. Gu C et al., 2017. Preparation of vitexin nanoparticles by combining the antisolvent precipitation and high pressures homogenization approAChEs followed by lyophilization for dissolution rate enhancement. Molecules, 22(11): 2038.
4. Hu M et al., 2018. Vitexin protects dopaminergic neurons in MPTP-induced Parkinson’s disease through PI3K/ Akt signaling pathway. Drug Design, Development and Therapy, 12:565–573.
5. Jayasinghe ULB et al., 2004. Glycosides from Grewia damine and Filicium decipiens. Natural Product Research, 18(6), pp. 499-502.
6. Karaoglan ES et al., 2020. Tyrosinase and cholinesterase inhibitory activities and molecular docking studies on apigenin and vitexin. Istanbul Journal of Pharmacy, 50(3), 268-271.
7. Kim GH et al., 2019. Improvement in neurogenesis and memory function by administration of Passiflora incarnata L. extract applied to sleep disorder in rodent models. Journal of Chemical Neuroanatomy, 98:27–40.
8. Kim JH et al., 2005. The isolation and antioxidative effects of vitexin from Acer palmatum. Arch Pharm Res, 28(2): 195-202. doi: 10.1007/BF02977715.
9. Lin YL et al., 2000. Flavonoid Glycosides from Terminalia catappa L. Journal of the Chinese Chemical Society, 47(1): 53-256.
10. Malar DS et al., 2018. Vitexin inhibits A beta (25-35) induced toxicity in Neuro-2a cells by augmenting Nrf-2/HO-1 dependent antioxidant pathway and regulating lipid homeostasis by the activation of LXR-alpha. Toxicology in Vitro, 50:160–171.
11. Nguyễn Thị Thu Hà et al., 2019. Quy trình tách chiết hỗn hợp chứa hợp chất vitexin và isovitexin từ vỏ hạt đậu xanh (Vigna radiata). Giải pháp hữu ích, Công báo sở hữu công nghiệp, tr. 378(b), quyển 1 (09.2019).
12. Qi Y et al., 2020. Vitexin improves neuron apoptosis and memory impairment induced by isoflurane via regulation of miR-409 expression. Advances in Clinical and Experimental Medicine, 29(1):135–145.
13. Ranjan R et al., 2023. Nutraceutical Potential of Vitexin: A Flavone Glycoside. The Journal of Phytopharmacology, 12(1): 44-50.
14. Sharma OP et al., 2009. DPPH antioxidant assay revisited. Food Chemistry, 113(4): 1202-1205.
15. Sun Y et al., 2013. Enrichment and antioxidant properties of flavone C-glycosides from trollflowers using macroporous resin. Food Chemistry, 141:533-541.
16. Tam LT et al., 2022. Screening of neuroprotective substance relevant to Alzheimer’s disease from seaweed species collected in Ninh Thuan and Khanh Hoa provinces, Vietnam. Academia Journal of Biology, 44 (4): 33-45.
17. Vinutha B et al., 2017. Screening of selected Indian medicinal plants for acetylcholinesterase inhibitory activity. J. Ethnopharmacol. Vol.109, pp. 359-363.
18. Zafari S. et al., 2020. Optimization of Solvent Systems for the Extraction of Vitexin as the Major Bioactive Flavonoid in Prosopis farcta. American Journal of Plant Sciences, 11:595-603. doi: 10.4236/ajps.2020.115045.